Теория активных столкновений
В теории активных столкновений считается, что акт превращения начальных веществ в конечные продукты совершается в момент столкновения активных молекул и протекает мгновенно. При этом молекулы рассматриваются как бесструктурные частицы, хотя в действительности химические реакции происходят путем постепенной перестройки молекул и перераспределения энергии между химическими связями.
Чтобы произошла реакция, частицы в момент столкновения должны:
– обладать некоторым минимальным избытком энергии, называемым энергией активации (Е);
– должны быть правильно ориентированы в пространстве относительно друг друга.
Рассмотрим кинетику бимолекулярной реакции в газовой фазе.
Согласно молекулярно-кинетической теории газов полное число столкновений Z12 за 1 сек в 1м3, если в системе реагируют молекулы двух разных видов, рассчитывается по уравнению:
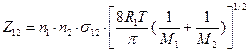 (молекул/см3∙с), (4.194)
(молекул/см3∙с), (4.194)
где n1, n2 – число молекул в 1 единице объема ( см3); 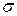 – эффективное сечение столкновения (
– эффективное сечение столкновения ( 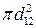 ); d12 =1/2 (d1 + d2) – эффективный диаметр столкновений;
); d12 =1/2 (d1 + d2) – эффективный диаметр столкновений; 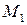 ,
, 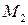 – молекулярные массы реагирующих молекул, г/моль;
– молекулярные массы реагирующих молекул, г/моль;
R1=8,314∙107 эрг/(моль·К); размерность выражения: 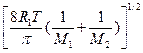 =
= 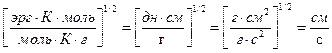 .
.
Если между молекулами газа нет взаимодействия и молекулы считаются сферами, то сечение столкновения можно рассчитать через радиусы молекул:
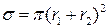 =
= 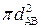 (4.195)
(4.195)
Притяжение между молекулами увеличивает сечение столкновения: 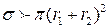 , а отталкивание – уменьшает его:
, а отталкивание – уменьшает его: 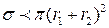 .
.
Оценка эффективного диаметра стокновения возможна по вязкости газов или плотности жидкостей и твердых тел.
1. По вязкости газов:
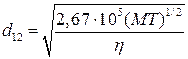 , (4.196)
, (4.196)
где 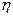 – вязкость газа, г/см·с; М – молекулярная масса, г/моль; Т – абсолютная температура, К .
– вязкость газа, г/см·с; М – молекулярная масса, г/моль; Т – абсолютная температура, К .
2. По значениям мольных объемов жидкостей или твердых веществ:
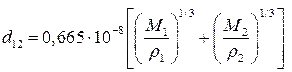 . (4.197)
. (4.197)
3. В некоторых случаях эффективный диаметр столкновения можно оценить приближенно, используя соотношение:
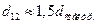 (4.198)
(4.198)
Число двойных столкновений между молекулами одного сорта равно:
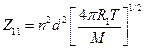 (молекул/см3∙с). (4.199)
(молекул/см3∙с). (4.199)
Число столкновений при nA= nB =1 называют частотой столкновений z0:
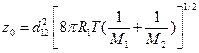 [1]. (4.200)
[1]. (4.200)
Так как 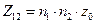 , то размерность частоты стокновений – см3/ (молекул ∙с).
, то размерность частоты стокновений – см3/ (молекул ∙с).
Эта величина равна вероятности столкновения двух частиц в единицу времени в единице объема.
Число столкновений активных молекул Zа, рассчитанное на основе закона распределения Максвелла-Больцмана, определяется соотношением:
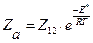 (молекул/см3∙с), (4.201)
(молекул/см3∙с), (4.201)
где Z12 - полное число столкновений, Е* - истинная энергия активации реакции.
Отношение
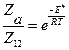 (4.202)
(4.202)
представляет собой долю активных столкновений из общего числа столкновений молекул.
Так как для бимолекулярной реакции с участием молекул двух разных видов каждое столкновения активных молекул должно приводить к исчезновению одной молекулы данного вида, то скорость реакции можно рассчитать исходя из числа активных столкновений:
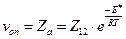 или
или 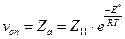 . (4.203)
. (4.203)
Подстановка уравнений (4.199) и (4.202) в (4.203) позволяет получить выражения для скорости бимолекулярной реакции на основе модели активных столкновений:
а) для молекул разного вида
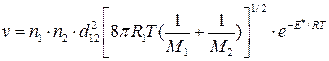 ; (4.204)
; (4.204)
б) для молекул одного вида
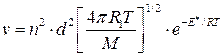 . (4.205)
. (4.205)
С другой стороны, согласно основному постулату химической кинетики, скорость реакции выражается уравнением:
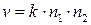 , (4.206)
, (4.206)
где n1,n2 – концентрации газов выраженные через число частиц в 1 см3.
Для взаимодействия одинаковых и неодинаковых молекул константа скорости равна:
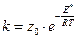 см3/ молекул ∙с. (4.207)
см3/ молекул ∙с. (4.207)
Константа скорости по теории активных столкновений может иметь разную размерность. Формулы пересчета констант:
k[ 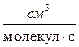 ] = k∙NA[
] = k∙NA[ 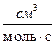 ] = k∙10-3[
] = k∙10-3[ 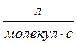 ] = k∙10-3∙NA[
] = k∙10-3∙NA[ 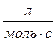 ] =
] =
= k∙6∙10-2∙NA[ 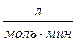 ].
].
С учетом выражения для частоты столкновения (4.200) вместо (4.207) можно записать формулы для расчета константы скорости:
а) для молекул разного вида
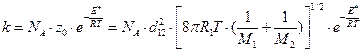 см3/моль×с; (4.208)
см3/моль×с; (4.208)
б) для молекул одного вида
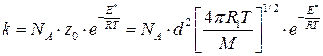 см3/моль×с , (4.208а)
см3/моль×с , (4.208а)
Уравнения (4.208) и (4.208а), где константа скорости рассчитана через число двойных соударений, называют уравнением Таутца – Льюиса. Оно применимо к бимолекулярным реакциям, как в растворе, так и в газовой фазе.
Теория активных столкновений может быть применена для оценки величин констант скоростей мономолекулярных реакций. В этих реакциях, приобретение молекулами избыточной энергии также происходит через бимолекулярные столкновения. Поэтому выражение для скорости реакции будет иметь тот же вид, что и для скорости бимолекулярной реакции с участием одинаковых молекул:
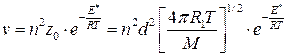 молекул/см3×с . (4.209)
молекул/см3×с . (4.209)
Согласно основному постулату химической кинетики скорость мономолекулярной реакции равна: 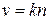 . Тогда, выражение для константы скорости мономолекулярной реакции, рассчитанное с использованием теории активных столкновений будет иметь вид:
. Тогда, выражение для константы скорости мономолекулярной реакции, рассчитанное с использованием теории активных столкновений будет иметь вид:
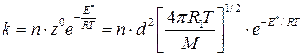 с-1. (4.209а)
с-1. (4.209а)
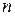 - число молекул в единице объема рассчитывается по формуле:
- число молекул в единице объема рассчитывается по формуле: 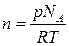 .
.
В этих уравнениях NА = 6,022·1023 моль-1– число Авогадро; р – парциальное давление. Если давление выражено в атм, то R3 = 82 см3∙атм /моль×К, если давление выражено в Па, то R3 = 82·1,013×105 см3∙Па /моль×К.
Сравнение скоростей реакций, рассчитанных по опытным данным, показывает, что в большинстве случаев 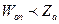 . Для согласования опытных и расчетных данных Дж. Христиансен (1924 г.) ввел поправочный множитель, названный стерическим фактором Р.
. Для согласования опытных и расчетных данных Дж. Христиансен (1924 г.) ввел поправочный множитель, названный стерическим фактором Р.
Первоначально предполагали, что стерический фактор связан с необходимой ориентацией сталкивающихся молекул и характеризует вероятность определенной геометрической конфигурации частиц при столкновении. В дальнейшем было установлено, что существует еще ряд причин, по которым 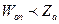 .
.
С учетом стерического фактора выражение для константы скорости на основе модели активных столкновений имеет вид:
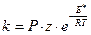 см3/ молекул ∙с. (4.210)
см3/ молекул ∙с. (4.210)
Сравнивая уравнения (4.208) и (4.209) с уравнением Аррениуса (4.65) получим уравнение для расчета предэкспоненциального множителя по теории активных столкновений:
а) для молекул разного вида
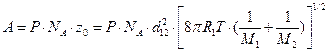 см3/моль×с; (4.211)
см3/моль×с; (4.211)
б) для молекул одного вида
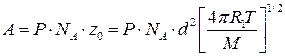 см3/моль×с , (4.212)
см3/моль×с , (4.212)
в) для мономолекулярных реакций
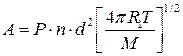 с-1. (4.212а)
с-1. (4.212а)
Из сравнения уравнения Аррениуса (4.65) с уравнением Траутца-Льюиса следует, что в уравнении Аррениуса предэкспоненциальный множитель не зависит от температуры, а в уравнении Траутца-Льюиса - пропорционален 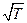 . Из этого следует, что величина истинной энергии активации Е* по физическому смыслу полностью аналогична аррениусовской энергии активации
. Из этого следует, что величина истинной энергии активации Е* по физическому смыслу полностью аналогична аррениусовской энергии активации 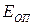 , но по численному значению отличается от неё. Сравнивая эти уравнения легко показать, что опытная энергия активации связана с теоретической (
, но по численному значению отличается от неё. Сравнивая эти уравнения легко показать, что опытная энергия активации связана с теоретической ( 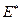 ) уравнением
) уравнением
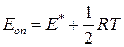 . (4.213)
. (4.213)
Теория активных столкновений, вводя понятие о стерическом факторе Р, не дает способов расчета этого параметра. Оценку значения Р обычно проводят путем сравнения значений констант скоростей реакций, рассчитанных по уравнению Аррениуса (4.65) - 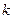 и по уравнениям теории активных столкновений (4.208) и (4.209) -
и по уравнениям теории активных столкновений (4.208) и (4.209) - 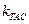
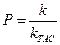 . (4.214)
. (4.214)
Стерический фактор можно также рассчитать по уравнению
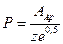 , (4.215)
, (4.215)
где 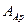 – предэкспоненциальный множитель в уравнении Аррениуса.
– предэкспоненциальный множитель в уравнении Аррениуса.
Дата добавления: 2016-01-09; просмотров: 3198;
