Кислотно-основная классификация катионов по группам
Данная классификация катионов по группам основана на использовании в качестве групповых реагентов водных растворов кислот и оснований — хлороводородной кислоты НС1, серной кислоты H2SО4, гидроксидов натрия NaOH или калия КОН (в присутствии пероксида водорода Н2О2) и аммиака NН3. Хотя эта классификация менее совершенна, чем сероводородная, однако используется чаще, т.к. при ее использовании не требуется получение и применение токсичного сероводорода.
В соответствии с кислотно-основной классификацией систематический ход качественного анализа смеси катионов может быть представлен следующей схемой (рис. 4.1) [3]. 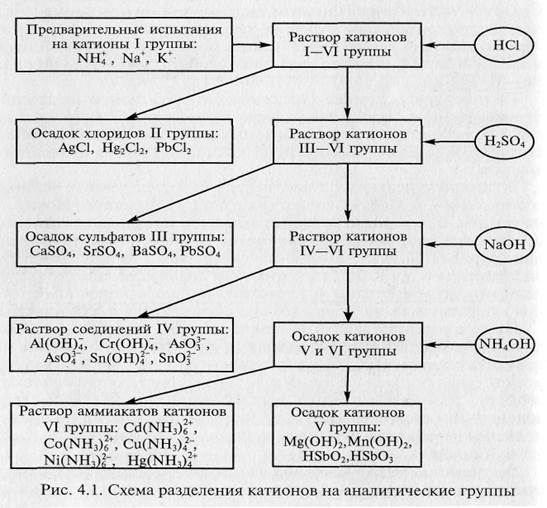
В результате получается шесть фракций раствора, содержащих катионы только своей аналитической группы. После этого на последующих стадиях анализа каждый катион может быть обнаружен «внутри» группы с помощью характерных (уже не обязательно специфичных) реакций.
Полная схема систематического анализа катионов по этой классификации (как и по любой другой) практически никогда не применяется при контроле ОС, качества лекарств и минерального сырья, однако отдельные элементы ее все же иногда используются в анализе.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп.
К первой аналитической группе относят катионы лития Li+, натрия Na+, калия К+ и аммония NH4+ (иногда катион лития не включают в эту группу из-за его слабой растворимости). Групповой реагент отсутствует.
Ко второй группе относят катионы серебра Ag+, ртути (1) Hg22+ и свинца Рb2+. Групповым реагентом на катионы второй аналитической группы является водный раствор хлороводородной кислоты (обычно с концентрацией 2 моль/л НС1); реже — растворы растворимых хлоридов. Групповой реагент осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде хлоридов серебра AgCl, ртути (1) Hg2Cl2 и свинца PbCl2;. Произведения растворимости этих трех хлоридов при комнатной температуре равны соответственно 1,78·10-10, 1,3·10-18 и 1,6 10-5. Как видно из этих данных, произведение растворимости хлорида свинца не очень мало, т.е. хлорид свинца заметно растворим в воде, особенно — при нагревании. Растворимость хлорида свинца в воде составляет (г/100 г воды): 0,99 при 25 °С и 2,62 при 80 °С. При действии группового реагента катионы свинца осаждаются из водного раствора не полностью — частично они остаются в растворе.
К третьей группе относят катионы кальция Са2+ стронция Sr2+ и бария Ва2+ Иногда к этой же группе относят и катионы свинца Рb2+ Групповым реагентом на катионы третьей группы является водный раствор серной кислоты (обычно с концентрацией 1 моль/л H2S04); реже - растворы водорастворимых сульфатов. При действии группового реагента катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSО4, стронция SrSО4 и бария BaSО4 (свинец осаждается в виде сульфата PbSО4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Кsо(CaSО4) = 2,5 10-5, для SrSО4 = 3,2 10-7, для BaSO4 = 1,1·10-10, для PbSО4 = 1,6·10-18. Произведение растворимости сульфата кальция не слишком мало; при действии группового реагента катионы кальция не полностью осаждаются из водного раствора в форме осадка сульфата кальция - часть ионов Са2+ остается в растворе. Для более полного осаждения катионов кальция в форме CaSО4 при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость CaSО4 уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах и щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Сa(HS04)2. Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2S04 с образованием комплекса (NH4)2[Ca(S04)2], сульфаты стронция и бария — вообще не растворяются.
Четвертая группа включает катионы алюминия Al3+, хрома Сг3+, цинка Zn2+, мышьяка As3+ и As5+, олова Sn2+ и Sn3+. Иногда сюда относят и катионы сурьмы (Ш) Sb3+ Групповым реагентом является водный раствор гидроксида натрия NaOH (или калия КОН) в присутствии пероксида водорода Н2О2 (обычно — избыток 2 моль/л раствора NaOH в присутствии Н202); иногда — без пероксида водорода. При действии группового реагента катионы четвертой аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке щелочи с образованием гидроксо-комплексов, например:
Al3+ + 3ОН- → А1(ОН)3 ↓, А1(ОН)3 + 3ОН- → [А1(ОН)6 ]3-
Cr3+ + 3ОН- → Сr(ОН)3 ↓, Cr(OH)3 + 3ОН- → [Cr(OH)6 ]3-
Zn2+ + 2ОН- → Zn(OH)2 ↓, Zn(OH)2 + 2ОН- → [Zn(OH)4]2-
Sn2+ + 2ОH- → Sn(OH)2 ↓, Sn(OH)2 + 4ОH- → [Sn(OH)6 ]4-
B присутствии пероксида водорода катионы Cr3+, As3+ и Sn2+ окисляются соответственно до хромат-ионов СгО42-, арсенат-ионов AsO3- и гексагидроксостаннат(VI)-ионов [Sn(OH6)]2-.
Осадки гидроксидов катионов четвертой аналитической группы не растворяются в водном аммиаке, за исключением гидроксида цинка Zn(OH)2, который растворяется в водном растворе аммиака с образованием аммиачного комплекса [Zn(NH3)4]2+.
При рассмотрении катионов четвертой аналитической группы мышьяк (III) и мышьяк(V) считают катионами As3+ и As5+ условно, так как в водных средах соответствующие соединения присутствуют обычно не в форме указанных катионов, а в форме анионов — арсенит-ионов AsO33- или AsO22-, - анионов ортомышьяковистой Н3АsО3 или метамышьяковистой HasO2 кислот и арсенат-ионов AsO3- - анионов мышьяковой кислоты H3AsO4. В концентрированных растворах соляной кислоты существуют комплексные анионы [AsCl4]- и [AsCI6]-.
Даже если бы исходное вещество и содержало формально мышьяк в виде катионов, например, АsС13, As2O3, As2O5 и т.д., то в водной среде оно гидролизуется с дальнейшим образованием анионной формы мышьяка(III) или мышьяка(V):
AsCl3 + 3Н20 = H3AsO3 + 3НС1
Аs2O3 + 3Н2O = 2Н3АsО3 = 2HAsO2 + 2Н2O
As2O5 + 3Н2О = 2H3AsO4 и т.д.
В соответствии с изложенным при проведении анализа по кислотно-основному методу обычно используют аналитические реакции на арсенит- или арсенат-анионы, а не на катионы мышьяка(III) или мышьяка(V).
К пятой аналитической группе относятся катионы магния Mg2+ марганца Мn2+, железа Fe2+ и Fe3+, сурьмы Sb3+ и Sb5+, висмута(III) Вi3+. Групповым реагентом является водный раствор щелочи (обычно 2 моль/л раствор NaOH) или 25%-й водный раствор аммиака. При действии группового реагента катионы пятой аналитической группы осаждаются из данного раствора в виде гидроксидов Mg(OH)2, Mn(OH)2, Fе(ОН)2, Fе(ОН)3, Sb(ОН)3, SbО(ОН)3, Вi(ОН)3. Гидроксиды катионов пятой аналитической группы не растворяются в избытке группового реагента, в отличие от катионов четвертой аналитической группы.
На воздухе гидроксиды марганца(II) и железа(III) постепенно окисляются кислородом:
4 Fе(ОН)2 + О2 + 2Н2О→ 4 Fе(ОН)3
2 Mn(OH)2 + О2 → 2 МnО(ОН)2
При действии группового реагента в присутствии пероксида водорода происходит окисление железа(II) до железа(III), марганца(II) – до марганца(IV), сурьмы(III) – до сурьмы(V):
2 Fe(OH)2 +H2O2 → 2 Fе(ОН)3
Mn(OH)2 + H2O2 → МnО(ОН)2 + Н2О
Sb(OH)2 + H2O2 → SbO(OH)2 + Н2О
К шестой аналитической группе относятся катионы меди(II) Сu2+, кадмия Cd2+, ртути(II) Hg2+, кобальта(II) Со2+ и никеля(II) Ni2+. Групповым реагентом является 25%-й водный раствор аммиака. При действии группового реагента на водные растворы, содержащие катионы шестой аналитической группы, вначале выделяются осадки различного состава, которые затем растворяются в избытке группового реагента (осадки соединений кобальта и ртути растворяются в избытке водного аммиака только в присутствии катионов аммония NH4+).
Катионы Cu2+, Co2+ и Ni2+ осаждаются из растворов их хлоридов в виде основных хлоридов CuOHCl, CoOHCl и NiOHCl, катионы кадмия — в форме гидроксида Cd(OH)2. При действии группового реагента на водные растворы хлорида ртути(II) HgCl2 или нитрата ртути(II) Hg(NO3)2 выделяются соответственно осадки HgNH2Cl и [Ohg2NH2]NO3.
Осадки основных солей меди(II), никеля(II) и гидроксида кадмия растворяются в избытке группового реагента с образованием соответствующих аммиачных комплексов:
CuOHCl + 4 NH3 → [Сu(NН3)4]2+ + ОН- + Сl-
NiОНСl+6 NН3 → [Ni(NН3)6]2+ +ОН- +С1-
Cd(OH)2 +4 NH3 → [Cd(NH3)4] 2+ +2 OH-
Осадки, выпавшие из растворов солей кобальта(II) и ртути(II) при действии группового реагента, растворяются в избытке аммиака в присутствии солей аммония с образованием аммиачных комплексов:
CoOHCl+5 NH3 + NH4+ → [Со(NH3)6]2+ +Сl +Н2O
HgNH2Cl + 2 NH3 + NH4+ → [Hg(NH3)4]2++ Cl-
[OHg2NH2]NO3 +4 NН3 +3 NH4+ → 2 [Hg(NH3)4]2+ + NO3- +H20
Аммиачный комплекс кобальта(II) грязно-желтого цвета окисляется на воздухе до аммиачного комплекса кобальта(III) вишнево-красного цвета.
Контрольные вопросы и задания
1. Какие бывают аналитические классификации катионов и на чем они основаны?
2. Охарактеризуйте подробнее кислотно-основную классификацию катионов (нарисуйте схему разделения на группы).
3. Дайте подробную характеристику какой-нибудь одной группы катионов и напишите их реакции с групповыми реагентами.
4. Перечислите характерные реакции катионов одной из групп и напишите их уравнения для одного из них.
(Воспользуйтесь для этого электронными текстами: «Качественный анализ S- P- и D-катионов»)
Рекомендуемая литература:
1. Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1. Общие теоретические основы. Качественный анализ. Учеб. для вузов. – М.: Высш. шк., 2001. – с. 288-291, 320-324.
2. Бессероводородные методы качественного полумикроанализа. /Под ред. А.П. Корешкова. – М.: Высш. школа, 1979.
3. Голубков Ю.М., Головачева В.А., Ефимова Ю.А. и др. Аналитическая химия. Учебник. /Под ред. А.А. Ищенко. – М.: Издательский центр «Академия», 2004. – с. 80.
Дата добавления: 2016-01-09; просмотров: 21399;
