5 страница. Рис. 32. Вскрытие рыб, контуры разрезов брюшной стенки (из Schaperclausa, 1979): а — карпа и других карповых; б — форели и лососевых; в — угря
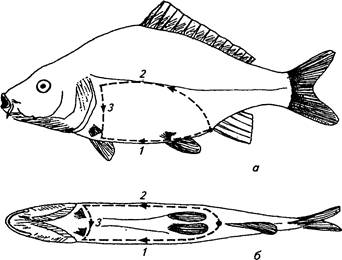
Рис. 32. Вскрытие рыб, контуры разрезов брюшной стенки (из Schaperclausa, 1979): а — карпа и других карповых; б — форели и лососевых; в — угря
вых ямок; два боковых разреза проходят от носовых ямок до затылочной области, а четвертый — в области затылка. Сначала проводят внешний осмотр оболочки головного мозга, затем его извлекают и характеризуют состояние вещества мозга, его кровенаполнение и др.
При осмотре скелетной мускулатуры обращают внимание на цвет, консистенцию, наличие кровоизлияний, отека, припухлостей, цист паразитов, степень прикрепления к костям.
Патологоанатомические изменения сопоставляют с клиническими симптомами, выявляют характерный комплекс признаков основного заболевания и сопутствующие осложнения (болезни), а также используют их для определения главной и непосредственной причины гибели рыб. В сомнительных случаях данные вскрытия уточняют с помощью гистологического исследования патматериала.
Обработку патматериала проводят общими методами гистологической техники. По нашему опыту, кусочки органов рыб лучше заливать в целлоидин-парафин, а жабры, кожу и плавательный пузырь — в целлоидин. Срезы окрашивают общепринятыми методами.
ПРАВИЛА ОТБОРА И ПЕРЕСЫЛКИ МАТЕРИАЛОВ ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Пробы воды берут в нескольких точках водоема с таким расчетом, чтобы собранные образцы отражали гидрохимическое состояние водоема или загрязненность его отдельного участка (зоны гибели рыб, места впадения ручья или сбросного канала, района интенсивного поверхностного стока и т.д.), а также в незагрязненном участке (выше по течению). В прудах и других проточных емкостях берут пробы на вытоке воды.
Пробы воды (не менее 2 л) отбирают батометром из поверхностных (на глубине 50 см) и придонных слоев в чистые стеклянные или полиэтиленовые бутылки (см. рис. 20). Перед заполнением посуду ополаскивают 2—3 раза исследуемой водой. В тех случаях, когда время транспортирования пробы составляет более 1 сут, их рекомендуется фиксировать различными консервантами в зависимости от целей исследования. Зимой воду при транспортировании следует утеплять, чтобы исключить ее замерзание.
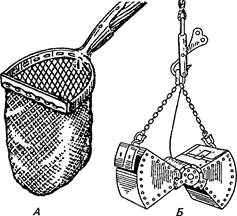
Пробы грунта (массой 2 кг) берут также из разных зон водоема дночерпателем Экмана или Кирпичникова. Грунт сушат на воздухе и упаковывают в широкогорлые банки или полиэтиленовые мешки (рис. 33).
|
|
| Рис. 33. Приспособления для взятия проб грунта и планктона: А — скребок; Б — дночерпатель; В — планктонная сетка |
Бентосные организмы (хирономиды, олигохеты, моллюски) в количестве 100—150 г отмывают от ила водой из водоема.
Планктон собирают планктонной сеткой, фильтруя такое количество воды, которое необходимо для получения около 50 г живой массы планктона.
Больных или подозрительных по заболеванию рыб доставляют в ветеринарную лабораторию живыми. Для исследования берут 10— 15 рыб на различных стадиях болезни.
Живых рыб перевозят в молочных бидонах или других емкостях, заполненных на 3/4 объема водой из того же водоема, откуда взята проба, или водой из артезианской скважины.
Летом при длительном транспортировании воду с рыбой постепенно охлаждают до температуры 12—15 °С, добавляя мелкие кусочки льда. Чтобы не вызывать у рыб температурного шока, нельзя допускать перепад температуры воды исходного водоема и транспортной емкости более 5—7 °С.
ь случае невозможности выполнить эти условия отбирают патматериалы от больных рыб и соответствующим способом консервируют. Для химико-токсикологического анализа пригодны снулая рыба или свежие трупы, которые отправляют в охлажденном, замороженном виде или консервируют 70°-ным спиртом.
Кусочки органов для бактериологических и вирусологических исследований отбирают стерильно, замораживают или консервируют 40—50%-ным раствором глицерина в кипяченой воде или физиологическом растворе. Кровь, экссудат и другой жидкий пат-материал доставляют в запаянных пастеровских пипетках. Пробы для микологических исследований консервируют в растворе антибиотиков (пенициллина или стрептомицина по 100 ЕД/мл раствора). В исключительных случаях делают посевы в лаборатории рыбоводного хозяйства.
Кровь для исследований берут пастеровской пипеткой из хвостовых сосудов (артемии и вены) или из сердца с соблюдением правил асептики и антисептики (рис. 34). Взятую кровь используют для посева, приготовления мазков, гематологических и биохимических исследований. Цельную кровь стабилизируют гепарином (1000 ЕД/мл) или лимоннокислым натрием. Сыворотку крови получают общепринятым методом, помещают в стерильные запаянные ампулы, а летом консервируют 5%-ным раствором фенола (1—2 капли на 1 мл сыворотки) или тиомерсалом из расчета 10 мг препарата на 10 мл сыворотки. Отобранные жидкие материалы перевозят в термосе со льдом.
 Материал для гистологических исследований берут от погибших и вынужденно убитых рыб. Мелких рыб (мальки и се-
Материал для гистологических исследований берут от погибших и вынужденно убитых рыб. Мелких рыб (мальки и се-
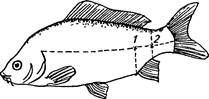
Рис. 34. Места взятия крови из хвостовых сосудов карпа:
1 — у сеголетков; 2—у карпов старшего возраста
|
голетки) после вскрытия брюшной полости фиксируют целиком, а от крупных особей берут органы или кусочки органов размером 2 х 3 см и толщиной 0,5—1,0 см. Кусочки из пораженных органов и тканей вырезают так, чтобы были захвачены нормальные и измененные участки. Независимо от степени поражения берут кусочки кожи с подлежащей мускулатурой, жабр, печени, почек, селезенки, сердца, кишечника, плавательного пузыря, головного мозга. Кишечник перед фиксацией осторожно вскрывают или делают на нем несколько надрезов, чтобы фиксирующая жидкость проникла в его полость. Головной мозг осторожно извлекают целиком после вскрытия черепной коробки. Подлежащий исследованию материал помещают в стеклянные банки и фиксируют 10%-ным нейтральным формалином, жидкостью Буэна или Карнуа.
С пораженных органов собирают паразитов и консервируют разными способами в зависимости от их систематического положения и размеров. Для определения простейших — инфузорий, жгутиконосцев — готовят мазки соскобов из жабр и кожных покровов на предметных стеклах, подсушивают их на воздухе и хранят в бумаге или фиксируют жидкостью Шаудина 15—20 мин. Из цист миксо-споридий также готовят мазки на предметных стеклах, которые сразу заключают в глицерин-желатину.
Гельминтов собирают с органов в солонки или чашки Петри, промывают от слизи водой или физиологическим раствором и выдерживают в них до гибели паразита. Моногенетических сосальщиков сразу заключают в глицерин-желатину на предметных стеклах или фиксируют в 4%-ном растворе формалина. Трематод, ленточных червей и скребней фиксируют 70°-ным спиртом между стеклами так, чтобы они расправились, а у скребней вышел хоботок; нематод и личинок цестод консервируют в жидкости Барбагалло. Паразитических рачков фиксируют в 70°-ном спирте или 4%-ном формалине, пиявок — в 4%-ном формалине, не раздавливая, и глохидий — в 70°-ном спирте.
Отобранные материалы подробно описывают, этикетируют, упаковывают в водонепроницаемую тару, опечатывают и высылают с нарочным в ветеринарную лабораторию или другое учреждение, где имеются возможности для исследования. В сопроводительном письме сообщают данные обследования водоема, указывают предполагаемый диагноз и какие лабораторные исследования необходимо провести.
БАКТЕРИОЛОГИЧЕСКИЕ И ВИРУСОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Для доказательства бактериальной или вирусной этиологии болезней рыб необходимо выделить возбудителя из организма больных рыб, идентифицировать его по культурально-морфологичес-ким, антигенным и биологическим признакам, воспроизвести болезнь на здоровых рыбах, повторно выделить (реизолировать) возбудителя от экспериментальных животных. Все эти исследования
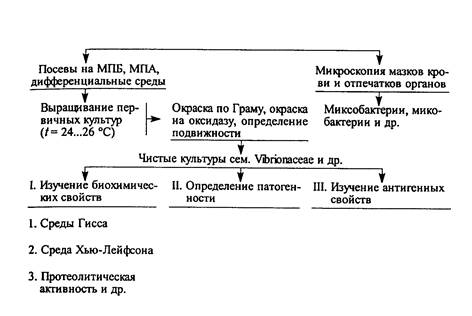
проводят по общепринятой схеме с учетом особенностей организма рыб и возбудителей болезней (схема I, табл. 11).
Схема I. Лабораторная диагностика бактериальных болезней рыб Патологический материал от больных рыб
1. Заражение рыб того же I. Капельная РА со
вида смесью сывороток
2. Клинические признаки 2. Капельная РА с моно-
валентной сывороткой
3. Реизоляция возбудите- 3. Пробирочная РА с
ля моновалентной сыво-
роткой
Бактериологические посевы проводят вначале с пораженных участков кожи, мышц (язвы, абсцессы и др.), жаберной ткани, крови и асцитной жидкости, а после вскрытия полости — обязательно с печени, почек или селезенки. Материал для вирусологических исследований отбирают из органов и тканей, где концентрируется вирус, а при малоизученных болезнях — из наиболее пораженных органов.
Язвы перед отбором патологического материала промывают стерильным физиологическим раствором; содержимое абсцессов, фурункулов, асцитной жидкости набирают пастеровской пипеткой после прижигания места прокола.
Для асептического вскрытия рыбу обездвиживают, фиксируют препаровальными иглами на деревянной или пробковой доске. Туловище с левой стороны освобождают от слизи и чешуи, удаляют грудной и брюшной плавники, дезинфицируют 70°-ным спиртом или фламбируют спиртовым тампоном. Брюшную стенку отсекают стерильными ножницами полулунным разрезом от ануса к жаберной крышке. Патматериал с паренхиматозных органов отбирают стерильно пастеровскими пипетками или бактериологической петлей.
Первичные бактериологические посевы проводят на МПБ, МПА и некоторые дифференциальные среды (например, кровяной агар, Китт—Тароцци). Патологический материал для вирусологи-

|
козов культивируют на МПА с добавлением 1 % сыворотки крупного рогатого скота, а также на глюкозо-дрожжевом агаре.
Сапролегниевые грибы хорошо растут на стерилизованных кипячением семенах конопли и льна, помещенных в агаровые пластины (1,5%-ный агар на воде), которые раскладывают в чашках Петри. Грибок растет при комнатной температуре в виде ватообразных колоний. Его также культивируют на МПА, агаре Чапека и Сабуро, для чего вырезают из них небольшие блоки, засевают культурой и раскладывают в чашки Петри.
ПОСТАНОВКА БИОЛОГИЧЕСКИХ ПРОБ
В ряде случае для установления окончательного диагноза на инфекционную болезнь, а также при решении вопроса о снятии карантина или карантинных ограничений с хозяйства ставят биологические пробы. При постановке их с целью определения патогеннос-ти возбудителей используют чистые культуры бактерий, вирусов, грибов. Кроме того, применяют нативные суспензии и взвеси, приготовленные из различных органов и тканей больных или подозреваемых в заражении рыб.
Биопробы ставят в аквариумах, ваннах или бассейнах, создавая в них оптимальные условия для жизни рыб и размножения возбудителей. Наблюдения ведут ежедневно, учитывают число погибших рыб, клинические признаки болезни и характер патологоанатоми-ческих изменений. Продолжительность опытов устанавливают с учетом инкубационного периода и длительности течения заболевания в естественных условиях. В опыты отбирают восприимчивых к данному заболеванию рыб из благополучного хозяйства. В каждой серии для заражения и контроля берут по 10 рыб.
При вирусных болезнях в качестве инфекционного материала берут свежеприготовленную вируссодержащую суспензию культуры клеток или безбактериальные фильтраты суспензий органов больных рыб. Количество вируссодержащего материала и способ заражения подбирают индивидуально для каждого заболевания. Материал вводят внутрибрюшинно, контактным методом, орошением жабр или выдерживанием рыб в воде, содержащей вирус. Параллельно ставят контрольные опыты.
Для подтверждения бактериальной природы болезни испытывают чистые культуры. Здоровых рыб заражают 2-суточными бульонными культурами внутрибрюшинно или внутримышечно в дозах 0,1—0,2 мл (рис. 35). Молодые или старые культуры для биопробы непригодны, так как у них меняются вирулентные свойства. Музейные штаммы перед опытом пассируют через восприимчивых рыб.
Для ускорения исследований предварительно патогенность определяют по ДНК-азной активности выделенных культур.
При постановке биологической пробы для диагностики микозов используют нативный материал, в котором содержится возбу-

|
Рис. 35. Внутрибрюшинное заражение рыб и введение лекарственных препаратов: а — фиксация рыб; б — место инъекций
дитель на всех стадиях развития, или выращивают патогенные грибы на специальных питательных средах до стадий, пригодных для заражения. Дозу вводимого патологического материала в каждом конкретном случае определяют титрованием на восприимчивых рыбах.
Биологическая проба считается положительной, если у 80 % зараженных рыб проявляется комплекс клинических
признаков и патологоанатомических изменений болезни и погибает не менее 50 % заболевших рыб при полном сохранении их в контроле, а также при выделении исходных возбудителей.
По окончании опытов воду в аквариумах обеззараживают, создавая в ней 4%-ную концентрацию формалина или 10%-ную концентрацию суспензии хлорной извести. Через 1 ч воду спускают в канализационную сеть, а рыб утилизируют. Весь инвентарь и посуду, бывшие в контакте с больной рыбой, дезинфицируют в 4%-ном растворе формальдегида в течение 1 ч.
При завершении биологической пробы в бетонированных бассейнах, земляных садках, карантинных прудах проводят дезинфекцию воды хлорированием, доводя содержание свободного хлора в воде до 4—5 мг/л. Через 24 ч воду пропускают через известковый фильтр (используя только свежую негашеную известь). После этого ложе прудов дезинфицируют негашеной (10 т/га) или хлорной известью (3 т/га) и оставляют без воды в течение 1 мес.
В случае, если ставится вопрос о снятии карантина или других ограничений, биопробу проводят непосредственно в прудах хозяйства согласно инструкции по борьбе с соответствующим заболеванием.
ГЕМАТОЛОГИЧЕСКИЕ И БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Кровь рыб четко реагирует на воздействие различных патогенных факторов: неблагоприятных условий среды, токсикантов, возбудителей заразных болезней и т. д. По изменениям крови можно судить о характере патологических процессов, происходящих в организме рыб. Результаты гематологических и биохимических исследований крови относятся к дополнительным и позволяют уточнить диагноз болезни.

|
Основными гематологическими показателями, используемыми при диагностике болезней рыб, являются: определение количества эритроцитов и лейкоцитов, уровня гемоглобина, скорости оседания эритроцитов (СОЭ) и выведение лейкограммы. Из биохимических показателей наиболее часто определяют содержание в крови сахара, общего белка и его фракций, активность основных ферментов (каталазы, пероксидазы, ацетилхолинэстеразы и многих других).
Для исследования крови рыб применяют те же методики, что и для теплокровных животных, с учетом ряда особенностей, связанных с клеточным составом, физико-химическими свойствами крови рыб и др. Активность ферментов рыб определяют при температуре 24-26 "С.
Кровь у рыб берут из хвостовых сосудов (артерии и вены) или из сердца с помощью пастеровских пипеток или шприца с максимально толстой иглой. Предварительно их орошают раствором гепарина или лимоннокислого натрия (цитрата натрия).
Место укола протирают от слизи сухим ватным тампоном, а потом смоченным 70°-ным спиртом. При взятии крови из сердца делают укол между грудными плавниками в месте прохождения белой линии под углом 90° до упора в позвоночник. При взятии крови из хвоста делают укол позади анального плавника, предварительно удалив его ножницами. Вращательными движениями иглы или пастеровской пипетки прокалывают кожу и под прямым углом продвигают их до упора в позвоночник. Кровь в обоих случаях легко идет по капилляру пипетки.
Для определения количества эритроцитов и лейкоцитов кровь набирают в смеситель меланжера, используемого для подсчета эритроцитов млекопитающих, до метки 0,5 или 1 и насасывают жидкость для окрашивания и разведения крови до метки 101 (раствор А: нейтральрот — 25 мг; хлорид натрия — 0,6 г, вода дистиллированная — 100 мл; раствор Б: кристаллвиолет — 12 мг, натрий лимоннокислый — 3,8 мг; формалин — 0,4 мл, вода дистиллированная — 100 мл). Раствор А набирают до половины расширения смесителя, раствор Б —до метки 101. Готовят эти растворы непосредственно перед исследованием; хранить их можно в холодильнике не более 1 нед. Под действием растворов ядра лейкоцитов окрашиваются в фиолетово-оранжевый цвет, эритроцитов — в синий цвет; видны контуры клеток.
После наполнения снимают резиновую трубку со смесителя, захватывают его между большим и средним пальцами и сильно встряхивают 2—5 мин, после чего выпускают из капилляра 3 капли жидкости, а 4-й каплей заряжают счетную камеру.
Принцип метода сводится к подсчету форменных элементов крови (эритроцитов, лейкоцитов) в камере Горяева. Сначала под малым увеличением микроскопа находят сетку и устанавливают равномерность распределения клеток, а затем подсчитывают их. Эритроциты считают в 5 квадратах (80 малых квадратов), располо-
ники, плавательный пузырь, половые железы, мышцы, головной и спинной мозг, хрящевая ткань.
При наружном осмотре обращают внимание на наличие кровоизлияний, язв, припухлостей, черных пятен на разных участках тела рыб, собирают всех видимых крупных эктопаразитов. Для обнаружения микроскопических организмов с поверхности тела, плавников соскабливают скальпелем слизь, помещают ее на предметное стекло, смешивают с несколькими каплями водопроводной воды и рассматривают при малом и среднем увеличениях микроскопа. В них находят жгутиконосцев, инфузорий, споровиков, моногеней.
Из носовых ямок пипеткой при многократном промывании их водой извлекают слизь, после чего микроскопируют. В слизи могут быть найдены инфузории, слизистые споровики, личинки трематод, пиявки,рачки.
Для исследования жаберного аппарата удаляют жаберные крышки, вырезают жаберные дуги с жаберными лепестками и помещают на препаровальные стекла, смачивают водой и рассматривают первоначально под лупой. У мелких рыб жаберные дуги с лепестками, у крупных — отделенные от дуг лепестки компрессируют между двумя стеклами с добавлением воды. Микроскопически исследуют со-скобы тканей с жабр при малом и среднем увеличениях микроскопа. На жабрах можно обнаружить простейших, моногеней, яйца сангвиникол, рачков и др.
Глаза извлекают из глазных впадин, помещают на предметное стекло и вскрывают острыми ножницами белочную оболочку. Стекловидное тело и хрусталик компрессируют между двумя предметными стеклами и просматривают под микроскопом. При этом часто обнаруживают личинок диплостом.
Для исследований на наличие трипанозом и трипаноплазм кровь берут пастеровской пипеткой из сердца или хвостовой вены. Каплю крови наносят на обезжиренное предметное стекло и добавляют каплю лимоннокислого натрия (цитрата натрия) для предотвращения свертывания, накрывают покровным стеклом, края которого замазывают вазелином, и микроскопируют.
Вскрывают брюшную полость дугообразным разрезом от анального отверстия к основанию левого грудного плавника. Боковую стенку отворачивают пинцетом и осматривают брюшную полость, обращая внимание на наличие ремнецов, нематод, а под серозными покровами и в брыжейке — на цисты и капсулы, содержащие личиночные стадии ленточных и круглых червей, миксоспоридий и др.
Сердце извлекают из сердечной полости, помещают на стекло, вскрывают, добавляют немного физиологического раствора и раздавливают другим стеклом. В нем обнаруживают сангвиникол, цисты миксоспоридий и др.
Печень, поджелудочную железу, селезенку, почки исследуют по одинаковой методике. Сначала проводят наружный осмотр этих органов, а затем их разрезают на кусочки, компрессируют и микро-
скопируют. Для исследования желчного и мочевого пузырей их помещают на стекло, вскрывают и собирают содержимое, после чего микроскопируют. В отдельных случаях делают соскобы со слизистых оболочек пузырей и также микроскопируют. Указанные органы являются местом обитания личинок гельминтов, многих видов споровиков и других паразитов.
В плавательном пузыре исследуют стенки и полость, в которых могут быть обнаружены миксоспоридий, личинки филометроиде-
сов.
Половые органы исследуют компрессорным методом. В них могут локализоваться миксоспоридий, плероцеркоиды лентецов. В желудочно-кишечном тракте исследуют несколько отрезков. Обнаруженных крупных гельминтов собирают и помещают в физиологический раствор. Содержимое кишок соскабливают скальпелем и исследуют компрессорно.
Для исследования мышц с рыбы снимают кожу и осматривают мышцы снаружи. Могут быть обнаружены личинки возбудителя чернопятнистого заболевания. Затем острым скальпелем разрезают мышцы на тонкие пластинки толщиной 3—5 мм, которые просматривают невооруженным глазом, а затем компрессируют и исследуют под микроскопом.
Головной мозг извлекают из черепной коробки и помещают на стекло, готовят раздавленные препараты. Мозговую ткань просматривают под микроскопом частями. Для исследования спинного мозга перерезают позвоночник в задней части, в канал вводят проволоку, извлекают содержимое на стекло и исследуют компрессорно.
Исследование хрящевой ткани особенно важно в форелевых хозяйствах, неблагополучных по вертежу. Споры возбудителя этого заболевания локализуются в слуховых капсулах и в межпозвоночных хрящах. Отделяют кости и хрящи головы, очищают от мышц позвоночник, измельчают их на мелкие кусочки, смачивают водой и частями исследуют под микроскопом при среднем увеличении.
Кроме исследования паразитов в живом и естественном виде на нативных препаратах проводят сбор и фиксацию материалов для последующей окраски, более подробного определения видов, приготовления постоянных препаратов. Особенно это важно при обнаружении редких или новых видов паразитов.
Простейших окрашивают по Романовскому — Гимзе, метилено-вым синим или железным гематоксилином. Для окраски трематод и цестод применяют квасцовый кармин. Моногенетических сосальщиков, миксоспоридий заключают в глицерин-желатину, замазывают сухие края покровных стекол бальзамом или черным лаком и хранят. Скребней и рачков также не красят, а для приготовления постоянных препаратов просветляют и заливают в бальзам. Окраску и заключение паразитов рыб проводят по общепринятым в паразитологии методикам (см. специальные руководства).
|
ТОКСИКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
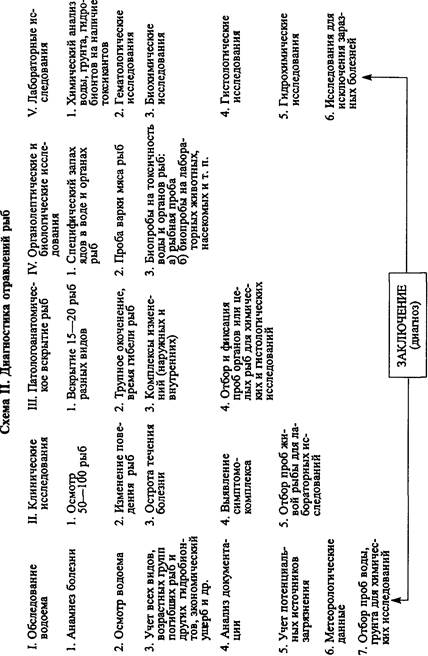
Отравления рыб диагностировать довольно сложно, так как они вызываются многочисленными ядовитыми веществами, часто возникают внезапно и проявляются недостаточно специфичными признаками. Поэтому диагноз ставят комплексно на основании данных токсикологического обследования водоема, клинико-ана-томических и разнообразных лабораторных исследований (см. схему II).
Токсикологическое обследование водоемов, проведение клинических исследований и патологоанатомического вскрытия рыб проводят теми же методами, что и при других болезнях рыб. В группу обязательных относят также органолептические, гидрохимические и химико-токсикологические исследования воды, грунта, органов рыб, беспозвоночных животных и растительности на наличие предполагаемого ядовитого вещества. В зависимости от показаний дополнительно проводят биологические, гематологические, биохимические, бактериологические, вирусологические и паразитологи-ческие исследования. Они необходимы для установления характера патологического процесса и дифференциальной диагностики токсикозов от заразных болезней рыб.
При оценке результатов комплексных диагностических исследований необходимо учитывать следующие особенности токсикозов рыб.
Обследование водоемов проводят комиссионно, с участием специалистов ветеринарной службы, органов рыбоохраны, санэпидемстанций и представителей местных администраций. При опросе очевидцев и личном осмотре водоемов важно определить участки наибольшей концентрации больных и погибших рыб, уточнить время появления, длительность и характер течения заболевания, видовой и возрастной состав пораженных рыб и других гидроби-онтов. Учитывают и обследуют при необходимости потенциальные источники поступления сточных вод: промышленные, коммунально-бытовые и сельскохозяйственные объекты, применение пестицидов и удобрений и поступление их с поверхностным стоком. Обязательно анализируют сопутствующие экологические факторы: перепады температуры воды, осадки, паводки и другие метеорологические условия. На месте определяют температуру, рН, прозрачность, запах, окраску воды, содержание в воде кислорода, отбирают пробы для полного гидрохимического анализа.
По клиническому течению различают острые и хронические токсикозы, которые отличаются от других болезней рядом признаков.
Острые отравления возникают внезапно; для них характерны кратковременное течение, массовая гибель разных видов и возрастных групп рыб, ракообразных, моллюсков, лягушек и других гидро-бионтов. В клинической симптоматике их преобладает нервно-паралитический синдром, проявляющийся комплексом таких признаков, как нарушение возбудимости, потеря равновесия и рас-
стройство координации плавания рыб, тремор мускулатуры и судорожное состояние, полная потеря рефлексов, депрессия и агония. Обращают внимание на последовательность этих стадий и зависимость проявления симптомов от тяжести отравления.
Хронические токсикозы отличаются длительным течением, сопровождаются постепенной гибелью рыб и проявляются чаще в стертой форме или бессимптомно. Для лабораторной диагностики используют показатели, отражающие избирательное действие ядовитых веществ. Например, для отравления фосфорорганическими и некоторыми карбаматными пестицидами характерно сильное угнетение активности ацетилхолинэстеразы (АХЭ) крови и головного мозга. Производные мочевины, гербициды группы 2,4-Д вызывают гипохромную или гемолитическую анемию, а нитриты и анили-ды — метгемоглобинемию. Полезны бывают и другие биохимические показатели, диагностическая ценность которых различна.
Патологоанатомическому вскрытию подвергают погибших и живых рыб с клиническими признаками отравления. В первую очередь обращают внимание на трупное окоченение и степень разложения трупов, по которым определяют примерные сроки гибели рыб. Следует учитывать, что скорость разложения трупов зависит от температуры воды и наиболее четко определяется по состоянию жаберного аппарата. При температуре 20 °С изменения жабр происходят примерно в следующие сроки: в начальной стадии (1—6 ч) бледнеют кончики жаберных лепестков, через 10—12 ч жабры приобретают серо-белую окраску, рисунок их сглаживается, а через 1 —2 сут мягкие ткани легко соскабливаются до обнажения жаберных лучей. Трупы рыб в это время размягчаются, мышцы легко отделяются от костей.
Трупное окоченение гораздо сильнее выражено и быстрее наступает при отравлении нервно-паралитическими ядами (пестицидами, органическими соединениями), чем веществами наркотического и местно-раздражающего действия. Кислоты и тяжелые металлы в высоких концентрациях коагулируют слизь. Она становится густой, творожистой, плохо отделяется. Щелочи, щелочно-земельные металлы, наоборот, разжижают ее. Она легко снимается или смывается с тела рыб.
При острых отравлениях ядами местно-раздражающего действия (щелочами, кислотами, тяжелыми металлами, аммиаком, хлором и др.) на поверхности тела, плавниках, жабрах часто встречаются точечно-пятнистые или полосчатые кровоизлияния, помутнение и даже разрушение роговицы глаз. В то же время резорбтив-ные яды не вызывают значительной местной реакции. Им свойственно общее действие, которое выражается нарушением кровообращения, застойной гиперемией, цианозом, дистрофическими изменениями и иногда отеком внутренних органов. Но выраженное пучеглазие, ерошение чешуи и особенно брюшная водянка (асцит) встречаются гораздо реже, чем при инфекционных заболеваниях.
Важно также заметить, что при большинстве токсикозов повреждаются жабры в разных формах: застой крови, цианоз, кровоизлияния, токсический отек, дистрофия и некроз поверхностного эпителия и глубоких тканей. Характер и тяжесть этих изменений зависят от агрессивности химического вещества и его концентрации.
Картина хронических отравлений менее характерна, чаще проявляется снижением упитанности рыб, анемией жабр, внутренних органов, атрофией печени, гидратацией мускулатуры и др. Для уточнения особенностей патологических процессов и дифференциации токсикозов от других болезней проводят гистологические исследования.
Дата добавления: 2016-01-07; просмотров: 3084;
