Оксид серы (VI). Серная кислота
Оксид серы (VI) (см. табл. 20) — бесцветная жидкость, затвердевающая при температуре 16,8°С в твердую кристаллическую массу. Он очень сильно поглощает влагу, образуя серную кислоту: SO3+Н2O= H2SO4
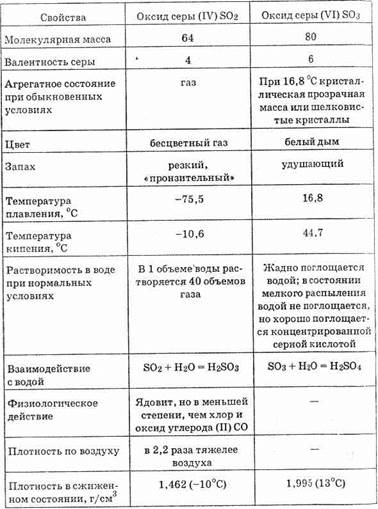
Таблица 20. Свойства оксидов серы
Растворение оксиды серы (VI) в воде сопровождается выделением значительного количества теплоты.
Оксид серы (VI) очень хорошо растворим в концентрированной серной кислоте. Раствор SO3 в безводной кислоте называется олеумом. Олеумы могут содержать до 70% SO3.
Получение
1. Оксид серы (VI) получают окислением сернистого газа кислородом воздуха в присутствии катализаторов при температуре 450°С (см. Получение серной кислоты):
2SO2+O2=2SO3
2. Другим способом окисления SO2 до SO3 является использование в качестве окислителя оксида азота (IV):
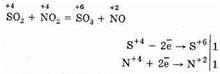
Образующийся оксид азота (II) при взаимодействии с кислородом воздуха легко и быстро превращается в оксид азота (IV): 2NO+О2=2NO2
который вновь может использоваться в окислении SO2. Следовательно, NO2 выполняет роль переносчика кислорода. Этот способ окисления SO2 до SO3 называется нитрозным. Молекула SO3 имеет форму треугольника, в центре которого
находится атом серы:
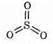
Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил шесть внешних электронов.
Химические свойства
1. SO3 — типичный кислотный оксид.
2. Оксид серы (VI) обладает свойствами сильного окислителя.
Применение
Оксид серы (VI) используют для производства серной кислоты. Наибольшее значение имеет контактный способ получения
серной кислоты. По этому способу можно получить H2SO4 любой концентрации, а также олеум. Процесс состоит из трех стадий: получение SO2; окисление SO2 в SO3; получение H2SO4.
SO2 получают обжигом пирита FeS2 в специальных печах: 4FeS2+11О2=2Fe2O3+8SO2
Для ускорения обжига пирит предварительно измельчают, а для более полного выгорания серы вводят значительно больше воздуха (кислорода), чем требуется по реакции. Газ, выходящий из печи обжига, состоит из оксида серы (IV), кислорода, азота, соединений мышьяка (из примесей в колчедане) и паров воды. Он называется обжиговым газом.
Обжиговый газ подвергается тщательной очистке, так как даже небольшое содержание соединений мышьяка, а также пыли и влаги отравляет катализатор. От соединений мышьяка и от пыли газ очищают, пропуская его через специальные электрофильтры и промывную башню; влага поглощается концентрированной серной кислотой в сушильной башне. Очищенный газ, содержащий кислород, нагревается в теплообменнике до 450°C и поступает в контактный аппарат. Внутри контактного аппарата имеются решетчатые полки, заполненные катализатором.
Раньше в качестве катализатора использовали мелкораздробленную металлическую платину. Впоследствии она была заменена соединениями ванадия — оксидом ванадия (V) V2O5 или сульфатом ванадила VOSO4, которые дешевле платины и медленнее отравляются.
Реакция окисления SO2 в SO3 обратимая:
2SO2+О2«2SO3
Увеличение содержания кислорода в обжиговом газе повышает выход оксида серы (VI): при температуре 450°С он обычно достигает 95% и выше.
Образовавшийся оксид серы (VI) далее подают методом противотока в поглотительную башню, где он поглощается концентрированной серной кислотой. По мере насыщения вначале образуется безводная серная кислота, а затем олеум. В дальнейшем олеум разбавляют до 98% -ной серной кислоты и поставляют потребителям.
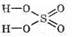
Структурная формула серной кислоты:
Физические свойства
Серная кислота — тяжелая бесцветная маслянистая жидкость, кристаллизующаяся при +10,4°С, почти вдвое (r=1,83 г/см3) тяжелее воды, не имеет запаха, нелетуча. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтому нельзя воду приливать к концентрированной серной кислоте — произойдет разбрызгивание кислоты. Для раз-
бавления надо серную кислоту приливать небольшими порциями к воде.
Безводная серная кислота растворяет до 70% оксида серы (VI). При нагревании отщепляет SO3 до тех пор, пока не образуется раствор с массовой долей H2SO4 98,3%. Безводная H2SO4 почти не проводит электрический ток.
Дата добавления: 2016-01-03; просмотров: 3119;
