Оксид серы (IV) и сернистая кислота
Оксид серы (IV), или сернистый газ, при обычных условиях бесцветный газ с резким удушливым запахом. При охлаждении до -10°С сжижается в бесцветную жидкость.
Получение
1. В лабораторных условиях оксид серы (IV) получают из солей сернистой кислоты действием на них сильными кислотами:
Na2SO3+H2SO4=Na2SO4+S02+H2O 2NaHSO3+H2SO4=Na2SO4+2SO2+2H2O 2HSO-3+2H+=2SO2+2H2O
2. Также сернистый газ образуется при взаимодействии концентрированной серной кислоты при нагревании с малоактивными металлами:
Cu+2H2SO4=CuSO4+SO2+2Н2О
Cu+4Н++2SO2-4=Cu2++ SO2-4+SO2+2H2O
3. Оксид серы (IV) образуется также при сжигании серы в воздухе или кислороде:
S+О2=SO2
4. В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.):
4FeS2+11О2=2Fe2O3+8SO2
Структурная формула молекулы SO2:
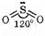
В образовании связей в молекуле SO2 принимают участие четыре электрона серы и четыре электрона от двух атомов кислорода. Взаимное отталкивание связывающих электронных пар и неподеленной электронной пары серы придает молекуле угловую форму.
Химические свойства
1. Оксид серы (IV) проявляет все свойства кислотных оксидов:
— взаимодействие с водой,
— взаимодействие с щелочами,
— взаимодействие с основными оксидами.
2. Для оксида серы (IV) характерны восстановительные свойства:
S+4O2+O02«2S+6O-23 (в присутствии катализатора, при нагревании)
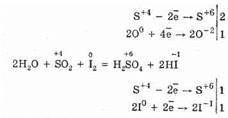
Но в присутствии сильных восстановителей SO2 ведет себя как окислитель:
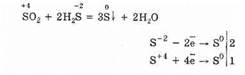
Окислительно-восстановительная двойственность оксида серы (IV) объясняется тем, что сера имеет в нем степень окисления +4, и поэтому она может, отдавая 2 электрона, окисляться до S+6, а принимая 4 электрона, восстанавливаться до S°. Проявление этих или других свойств зависит от природы реагирующего компонента.
Оксид серы (IV) хорошо растворим в воде (в 1 объеме при 20°С растворяется 40 объемов SO2). При этом образуется существующая только в водном растворе сернистая кислота:
SO2+Н2О«H2SO3
Реакция обратимая. В водном растворе оксид серы (IV) и сернистая кислота находятся в химическом равновесии, которое можно смещать. При связывании H2SO3 (нейтрализация кисло-
ты) реакция протекает в сторону образования сернистой кислоты; при удалении SO2 (продувание через раствор азота или нагревание) реакция протекает в сторону исходных веществ. В растворе сернистой кислоты всегда имеется оксид серы (IV), который придает ему резкий запах.
Сернистая кислота обладает всеми свойствами кислот. В растворе диссоциирует ступенчато:
H2SO3«Н++HSO-3 HSO-3«Н++SO2-3
Термически неустойчива, летуча. Сернистая кислота, как двухосновная, образует два типа солей:
— средние — сульфиты (Na2SO3);
— кислые — гидросульфиты (NaHSO3).
Сульфиты образуются при полной нейтрализации кислоты щелочью:
H2SO3+2NaOH=Na2SO3+2Н2О
Гидросульфиты получаются при недостатке щелочи:
H2SO3+NaOH=NaHSO3+Н2О
Сернистая кислота и ее соли обладают как окислительными, так и восстановительными свойствами, что определяется природой партнера по реакции.
1. Так, под действием кислорода сульфиты окисляются до сульфатов :
2Na2S+4O3+О02=2Na2S+6O-24
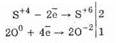
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:
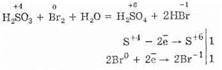
5H2S+4O3+2KMn+7O4=2H2S+6O4+2Mn+2S+6O4+K2S+6O4+3Н2O
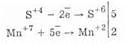
2. В присутствии же более энергичных восстановителей сульфиты проявляют окислительные свойства:
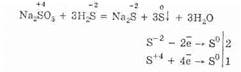
Из солей сернистой кислоты растворяются почти все гидросульфиты и сульфиты щелочных металлов.
3. Поскольку H2SO3 является слабой кислотой, при действии кислот на сульфиты и гидросульфиты происходит выделение SO2. Этот метод обычно используют при получении SO2в лабораторных условиях:
NaHSO3+H2SO4=Na2SO4+SO2+H2O
4. Растворимые в воде сульфиты легко подвергаются гидролизу, вследствие чего в растворе увеличивается концентрация OH--ионов:
Na2SO3+НОН«NaHSO3+NaOH
Применение
Оксид серы (IV) и сернистая кислота обесцвечивают многие красители, образуя с ними бесцветные соединения. Последние могут снова разлагаться при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие SO2 и H2SO3 отличается от белящего действия хлора. Обычно рксидом серы (IV) белят шерсть, шелк и солому.
Оксид серы (IV) убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др. Используется также при перевозке и хранении фруктов и ягод. В больших количествах оксид серы IV) применяется для получения серной кислоты.
Важное применение находит раствор гидросульфита кальция CaHSO3 (сульфитный щелок), которым обрабатывают древесину и бумажную массу.
Дата добавления: 2016-01-03; просмотров: 7567;
