Общая характеристика металлов главной подгруппы II группы
В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относятся к семейству щелочноземельных металлов (см. табл. 29).
Это s-элементы. В виде простых веществ типичные металлы. На внешнем уровне имеют по два электрона. Отдавая их, они проявляют в соединениях степень окисления +2. В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах. Это связано с некоторым сжатием электронных оболочек, так как s-подуровень внешнего электронного слоя у них завершен, поэтому электроны ими удерживаются сильнее.
Таблица 29.
Физические и химические свойства элементов главной подгруппы II группы
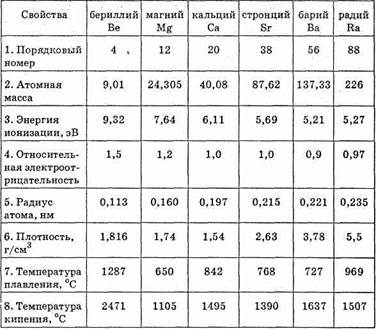
С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства закономерно возрастают. Более ярко они проявляются у щелочноземельных металлов.
Следует отметить, что по своим свойствам бериллий и магний несколько отличаются от щелочноземельных металлов кальция, стронция и бария (последний элемент группы радий отличается от остальных щелочноземельных металлов природными радиоактивными свойствами).
Кальций, стронций и барий окисляются на воздухе до оксидов состава RO, поэтому их хранят без доступа воздуха либо в герметически закрытых сосудах, либо под слоем эфира или керосина. Бериллий и магний при комнатной температуре на воздухе покрываются тонкой оксидной пленкой, предохраняющей их от дальнейшего окисления. Для получения оксидов этих металлов их необходимо поджечь:
Be+O2=ВеО
Кальций, стронций и барий разлагают воду уже при обычной температуре с образованием соответствующих гидроксидов и выделением водорода:
R+2H2O=R(OH)2+H2
Гидроксиды щелочноземельных металлов малорастворимы в воде, их растворимость возрастает от Са(ОН)2 к Ва(ОН)2.
Бериллий с водой не взаимодействует, т.к. образующаяся в первый момент пленка малорастворимого гидроксида бериллия Ве(ОН)2 пассивирует металл. Гидроксид бериллия Ве(ОН)2 имеет амфотерный характер:
Be2++2ОН-«Ве(ОН)2«Н2ВеO2«2Н++BeO2-2
Однако свойства Ве(ОН)2 как основания выражены гораздо отчетливее кислотных.
Магний реагирует с водой лишь при нагревании:
Mg+2Н2O=Mg(OH)2+H2
Гидроксид магния — типичное основание.
При нагревании все металлы главной подгруппы II группы активно реагируют с водородом (давая гидриды RH2, с галогенами, серой, азотом, фосфором, углеродом.
Из металлов этой подгруппы наибольшее значение имеют магний и кальций.
Дата добавления: 2016-01-03; просмотров: 5105;
