Токсичность (ЛД50) некоторых ФОС для белых мышей
| Название вещества | Способ введения | Токсичность, мг/кг |
| О,О-Диметил-S-(1,2-дикарбоэтоксиэтил)дитиофосфат (карбафос, малатион) | через рот | 400 - 930 |
| О,О-Диметил-О-(2,2-дихлорвинил)фосфат (ДДВФ, дихлорофос) | через рот | 75 - 175 |
| Диэтил-(4-нитрофенил)-тиофосфат (паратион) | через рот внутрибрюшинно | 25,0 5,5 |
| Диэтил-(4-нитрофенил)-фосфат (фосфакол, параоксон) | подкожно | 0,8 |
| Диизопропилфторфосфат (ДФФ) | через рот подкожно внутривенно | 36,8 0,4 |
| N,N-диметиламидо-О-этилцианфосфат (табун) | подкожно внутрибрюшинно внутривенно | 0,6 0,6 0,15 |
| О-изопропилметилфторфосфонат (зарин) | подкожно внутрибрюшинно | 0,2 0,2 |
| О-диметилизобутилметилфторфосфонат (зоман) | подкожно | 0,06 |
| О,О-диэтоксифосфорилтиохолин | подкожно внутрибрюшинно | 0,26 0,14 |
| Метилфторфосфорилгомохолин | внутрибрюшинно внутривенно | 0,05 0,006 |
Все ФОС обладают высокой реакционной способностью. Особое значение придают реакциям фосфорилирования, гидролиза и окисления, поскольку именно эти реакции определяют стойкость токсикантов в окружающей среде, имеют отношение к метаболизму и механизму токсического действия ядов в организме, на них основаны некоторые принципы дегазации, обнаружения, антидотной профилактики и терапии интоксикаций.
ФОС легко отдают электроны, активно вступают в реакции с электрофильными группами других соединений и за счет этого фосфорилируют многие вещества (аминокислоты, полифенолы, гидроксиламин, гидроксамовые кислоты и др.).
В качестве примера приводим реакцию фосфорилирования зарином гидроксиламина:
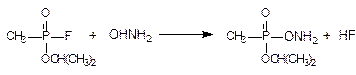
Все ФОС при взаимодействии с водой подвергаются гидролизу с образованием нетоксичных продуктов. Скорость гидролиза ФОС, растворенных в воде, различна (например, зарин гидролизуется быстрее, чем зоман, а зоман – быстрее, чем V-газы).
В общей форме реакция гидролиза может быть представлена следующим образом:
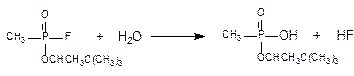
Реакция гидролиза ФОС с разрывом ангидридной связи происходит и в организме, как спонтанно, так и при участии энзимов.
В результате реакции окисления, ФОС также разрушаются, однако в ряде случаев (при окислении фосфотионатов до фосфатов) некоторые вещества даже повышают свою активность. Это иллюстрируется примером

Токсичность параоксона для млекопитающих и человека выше, чем паратиона.
Важнейшие свойства фосфорорганических отравляющих веществ представлены в таблицах 44-46.
Таблица 44.
Дата добавления: 2016-01-03; просмотров: 873;
