Теория электролитической диссоциации
Вещества, проводящие в водном растворе электрический ток - соли, основания, кислоты называются электролитами.
Распад вещества на сольватированные ионы под действием молекул растворителя называется ионизацией вещества в растворах или электролитической диссоциацией.
Идея о распаде вещества в растворе на ионы была высказана С.Аррениусом (1887). Основоположниками современной теории электролитической диссоциации являются И.А.Каблуков и В.А.Кистяковский.
Сущность теории электролитической диссоциации:
- Электролиты при растворении в воде распадаются (диссоциируют) на положительные и отрицательные ионы.
- Под действием электрического тока положительно заряженные ионы движутся к катоду, отрицательно заряженные к аноду. Первые называют катионами, вторые - анионами.
- Диссоциация - процесс обратимый, поскольку параллельно идет распад молекул на ионы (диссоциация) и процесс соединения ионов в молекулы (ассоциация).
| _ + |
| + -_ |
| + - |
| + - |
| Cl- |
| Na+ |
| + - |
| + - |
| + - |
| _ + |
“+” и “-” - го ионов. Между
ионами и диполями воды возникают силы взаимного притяжения, в результате связь между ионами ослабевает, происходит диссоциация на ионы. При этом, образуются гидратированные ионы, т.е. ионы химически связаны с молекулами воды.
2. Диссоциация солей, кислот, оснований
Кислотами - называют электролиты, которые при диссоциации образуют в качестве катионов только ионы водорода.
HCI = H+ + CI-
CH3COOH = CH3COO- + H+
Кислоты в воде диссоциируют на ионы водорода и кислотные остатки - анионы. Основность кислот определяется числом ионов водорода, которые образуются при диссоциации одной ее молекулы.
Двух и многоосновные кислоты диссоциируют ступенчато:
H2SO4 = H + + HSO4- (1ступень)
HSO4- = H+ + SO4 2- (2ступень)
Диссоциация многоосновной кислоты протекает главным образом по 1 ступени, в меньшей мере по 2 и лишь в незначительной степени по третьей.
Основаниями называются электролиты, которые при диссоциации образуют в качестве анионов только гидроксид - ионы.
KOH = K + + OH-
NH4OH = NH4 + + OH-
Кислотность основания определяют числом гидроксильных групп в его молекуле. Двух и многоосновные основания диссоциируют ступенчато:
Са(ОН)2 = СаОН + + ОН - (1 ступень)
СаОН- = Са2+ + ОН - (2 ступень)
Соли - электролиты, которые при диссоциации образуют катионы металлов (относится и катион аммония NH4+) и анионы кислотных остатков.
NaCI = Na+ + CI-
K3PO4 = 3K+ + PO43-
В зависимости от состава различают следующие типы солей: средние, кислые, основные, двойные и комплексные.
Диссоциация кислых солей:
KHSO4 = K+ + HSO4-
K2HPO4 = 2K + + HPO42-
Анионы кислых солей подвергаются дальнейшей диссоциации. Т.е. кислые соли диссоциируют ступенчато: вначале отщепляются ионы Ме, а затем ионы водорода.
Диссоциация основных солей:
Mg(OH)CI = Mg(OH)+ + CI-
Al(OH)2CI = Al(OH)2 + + CI-
Катионы основных солей подвергаются дальнейшей диссоциации, т.е. основные соли также диссоциируют ступенчато.
Двойные соли:
KAl(SO4)2 = K + + Al3+ + 2SO42-
Комплексные соли:
K4 [Fe(CN)6 ] = 4K + + [Fe(CN)6 ]4-
[Fe(CN)6 ] 4- = Fe 2+ + 6CN-
Протонная (протолитическая) теория.
Следующим шагом в развитии представлений о кислотах и основаниях явилась протолитическая (протонная) теория Бренстеда - Лоури (1923). Согласно этой теории, кислоту считают донором протонов, а основание - акцептором протонов. При взаимодействии кислота отдает протон, а основание принимает протон. Соотношение между основанием и кислотой можно представить схемой:
Основание + Протон = Кислота
Основание и кислота, связанные данным соотношением, называются сопряженными.Взаимодействие между кислотой и основанием согласно протонной теории обозначается схемой:
Кислота 1 + Основание 2 = Кислота 2 + Основание1
Например, реакцию аммиака и фторида водорода можно записать уравнением:
HF + NH3 = NH 4+ + F -
кислота 1 основание 2 кислота 2 основание1
В этом уравнении кислоте HF соответствует сопряженное основание F- , а основанию NH3 - cопряженная кислота NH4 + . В зависимости от партнера то или вещество может быть или кислотой, или основанием.
В 1924 г Дж. Льюис выдвинул и обосновал электронную теорию кислот и оснований, согласно которой кислота является акцептором, а основание - донором электронов. Взаимодействие кислоты и основание, по Льюису, приводит к образованию ковалентной связи по донорно-акцепторному механизму. Электронная теория охватывает более широкий круг соединений, чем протонная теория, однако с ее помощью невозможно установить силу кислот и оснований. Поэтому эти теории дополняют друг друга.
3. Степень диссоциации.
Растворы электролитов характеризуются степенью диссоциации.
Степень диссоциации ( α ) - это отношение числа распавшихся на ионы молекул n к общему числу растворенных молекул N:
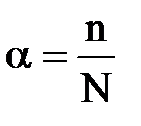
Степень диссоциации определяется опытным путем и выражается в долях единицы или в процентах. Если диссоциация отсутствует, то α = 0, если электролит полностью распадается на ионы, то α = 1 или 100% . Если же α= 70 % , то это означает, что из 100 молекул данного электролита 70 распалось на ионы.
Основываясь на значение степень диссоциации, электролиты делятся:
> 30 % - сильные электролиты;
от 3 до 30 % - средние электролиты;
< 3 % - слабые электролиты.
На степень диссоциации влияют следующие факторы:
1. Природа растворителя.
2. Природа растворенного вещества.
3. Температура. У сильных электролитов с повышением температуры степень диссоциации уменьшается, у слабых проходит через максимум (в области 60 С).
4. Концентрация растворов. С увеличением концентрации раствора степень диссоциации уменьшается.
5. Наличие одноименных ионов. Добавление одноименных ионов уменьшает степень диссоциации.
4. Характеристика сильных и слабых электролитов
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы.
Cлабые электролиты - при растворении в воде диссоциируют на ионы лишь частично.
| Класс электролита | Сильные электролиты | Слабые электролиты |
| Соли | Большинство солей. Практически все соли с однозарядными катионами | Галогениды некоторых металлов (Hg2+, Cd2+, Bi3+); некоторые соли многоосновных органических кислот |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3, HClO3, HClO4, HMnO4 | Остальные слабые |
| Основания | Гидроксиды элементов групп IA (Li – Fr) и IIA (Ca – Ra) | Остальные слабые |
| Комплексные соединения | Имеющие внешнюю сферу | Не имеющие внешней сферы |
Константа диссоциации
Электролитическая диссоциация - это обратимый процесс. А ко всякому обратимому процессу применим закон действующих масс.
Например, диссоциация уксусной кислоты:
СН3СООН = СН3СОО- + Н+
Kд = 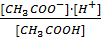
Это выражение носит название константы диссоциации. В общем виде для диссоциации электролита:
KnAm = n K+ + m A-
Кдис. = 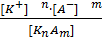
[K +] - концентрация катиона; [A -] - концентрация аниона; [KnAm] - концентрация недиссоциированных молекул.
Константа диссоциации зависит:
- от природы электролита и растворителя;
- от температуры.
Но не зависит от концентрации электролита в растворе.
Связь между константой и степенью диссоциации электролита:
К = 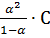
Это уравнение называется законом разведения (разбавления) Оствальда.
Если степень диссоциации мала, то К = α2С и
α = 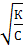
Степень диссоциации возрастает с уменьшением концентрации электролита в растворе.
Константа диссоциации характеризует силу кислот и оснований: чем больше константа, тем сильнее диссоциируют слабые электролиты в водном растворе.
Рассмотрим равновесие, установившееся между недиссоциируемыми молекулами и ионами при электролитической диссоциации:
СН3 СООН = СН3СОО- + Н+
Установившееся равновесие можно смещать во взаимно противоположных направлениях.
При разбавлении раствора уксусной кислоты водой равновесие сместится в прямом направлении - степень диссоциации кислоты возрастает.
И наоборот, при упаривании раствора равновесие смещается в обратном направлении - степень диссоциации уменьшается.
Смещение равновесия можно добиться, изменяя равновесные концентрации. Так, при введении в раствор уксусной кислоты ацетат-иона СН3СОО-, т.е. одноименного иона, равновесие сместиться в обратном направлении и степень диссоциации уменьшится. А уменьшение концентрации одного из ионов смещает равновесие в прямом направлении.
Наоборот, введение разноименных ионов усиливает диссоциацию электролита и увеличивает степень диссоциации.
Теория Дебая - Хюккеля.
Сильные электролиты закону действующих масс не подчиняются, константа диссоциации не является постоянной величиной при различных концентрациях.
Это неподчинение объясняет теория сильных электролитов, предложенная Дебаем и Хюккелем (1923). Согласно этой теории, сильные электролиты в водных растворах нацело диссоциируют на ионы. В этом случае концентрация ионов в растворе большая. Между противоположно заряженными ионами действуют электростатические силы притяжения. В результате, каждый ион окружается “ионной атмосферой”, состоящей из ионов противоположного заряда. Например, в растворе хлорида натрия вокруг движущихся ионов Na + создается атмосфера из хлорид ионов CI-, и наоборот, вокруг СI- - создается ионная атмосфера из Na+ . Это уменьшает подвижность ионов.
Межионные силы понижают активность ионов. Для учета этого влияния введен термин “активность”.
Активностью иона или молекулы(а) называется их концентрация, соответственно которой они действуют в химических реакциях.
Отношение активности к концентрации называют коэффициентом активности ( f):
f = а/с или а = f ∙ с
Коэффициент активности иона определяется ионной силой раствора.
Ионная сила раствора (μ) - равна полусумме произведений молярных концентраций всех присутствующих ионов на квадраты их зарядов.
μ = 1/2∙(С1∙Z12 + С2∙Z22 +…. Сn∙Zn2)
где С1, С2,.........Сi - концентрация ионов; Z1, Z2 ...... Z i - их заряды.
Для очень разбавленных растворов (0,01 - 0,05М) зависимость коэффициента активности от ионной силы раствора выражается формулой Дебая - Хюккеля:
lg f = - 0,5 Z2 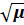
5. Роль растворов
В природе и технике растворы имеют огромное значение. Растения усваивают вещества в виде растворов. Усвоение пищи связано с переводом питательных веществ в раствор. Клеточный сок, например, состоит из воды и различных веществ, чаще всего в виде коллоидного раствора. Растворами являются кровь, лимфа. Все природные воды являются растворами.
| <== предыдущая лекция | | | следующая лекция ==> |
| Классификация методов качественного анализа. | | | Температуры и давления |
Дата добавления: 2016-01-03; просмотров: 2449;
