Гибридизация атомных орбиталей
Идею о гибридизации орбиталей в атоме выдвинул амер. физик Л.Полинг в 1931 г. Если у атома, выступающего в химическую связь, участвуют разные, но близкие по энергиям АО происходит их гибридизация (смешение), в результате чего они приобретают одинаковую форму и становятся равноценными по энергии. В гибридных АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание.
Как физический процесс, гибридизация орбиталей не существует. Теория гибридизации представляет собой удобную модель наглядного описания молекул.
В зависимости от числа и вида участвующих в гибридизации АО, различают следующие типы гибридизации:
- при комбинации 1S и 1Р орбитали возникают две SP -гибридные орбитали, расположенные симметрично под углом 180º . Например, у атома бериллия SP-гибридизация проявляется в молекуле ВеCI2 , которая имеет линейную форму.
- Комбинация трех орбиталей - 1S- и 2Р-типа - приводит к образованию трех SP2 - гибридных орбиталей, расположенных под углом 120º. Например, вследствии SP2 - гибридизации орбиталей атома бора молекула ВСI3 имеет треугольную форму.
- Комбинация четырех орбиталей - 1S- и 3Р-типа - приводит к SP3 -гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве под углом 109º к четырем вершинам тетраэдра. Тетраэдрическое расположение связей и форма тетраэдра характерны, например для ССI4 (рис.6).
-Комбинация орбиталей типа 1S, 3Р и 1d приводит к SP3 d-гибридизации, форма орбиталей - тригональная бипирамида.
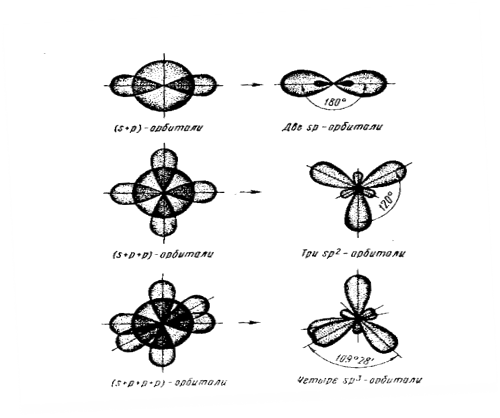
-В случае SP3d2 - гибридизации - октаэдр; Пентагональная бипирамида соответствует SP3 d3 - гибридизации.
рис. 6
Ионная связь
Ионная связь возникает за счет электростатического притяжения между катионом и анионом, которые образуются путем практически полного смещения общей электронной пары (или пар) к одному из атомов, например,в NaCl: 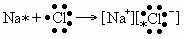
Так как электрическое поле иона сферическое, то для ионной связи в отличие от ковалентной связи характерны ненаправленность и ненасыщаемость.
Ионная связь проявляется в твердых веществах с ионной кристаллической решеткой. Вещества с ионной решеткой обладают высокой твердостью. Они тугоплавки и малолетучи.
Металлическая связь
У большинства металлов на внешней электронной оболочке имеется малое число электронов, и металлы их легко отдают. Поэтому в узлах кристаллических решеток металлов находятся положительно заряженные ионы, а между ними полусвободные валентные электроны (электронный “газ”). Связь между ионами металла и его нелокализованными электронами называется металлической связью.
Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает электрическую проводимость и теплопроводимость, а также ковкость и пластичность металлов.
Водородная связь
Водородная связь - связь двух электроотрицательных элементов. Водородная связь имеет частично электрический, частично донорно-акцепторный характер. Она может быть межмолекулярной и внутримолекулярной. Межмолекулярная вод. связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент (F, O, N, CI, S). Обычно вод.связь обозначают точками или пунктиром и этим показывают, что она намного слабее ковалентной связи ( примерно в 15-20 раз). Водород.связь обуславливает ассоциацию молекул. Например, образование димеров воды (Н2О)2 и уксусной кислоты (СН3СООН)2 можно представить схемой:
Н - О ............Н - О
| |
Н Н
O……….H - O
СН3 - С С - СН 3
O – H……….O
Возникновение водородной связи привело к объединению в случае воды и уксусной кислоты двух ее молекул с образованием циклической структуры.
Вод. связи возникают и внутри одной молекулы между двумя функциональными группами. В случае образования внутримолекулярной вод.связи теряется способность к ассоциации молекул. Изомеры с такой связью обладают большей летучестью и растворимости в органических растворителях.
Вод.связь оказывает влияние на скорость хим.реакции и свойства веществ. Наличием вод.связи объясняется более высокая точка кипения воды. Вод.связь в значительной мере определяет структуру белков, нуклеиновых кислот и другие биологически важных соединений.
Дата добавления: 2016-01-03; просмотров: 2071;
