Природа химической связи.
Многие физические и все химические свойства веществ определяются типом связи. Атомы, не обладающие завершенным уровнем, находятся в неустойчивом энергетическом состоянии. Основной движущей силой, приводящей к образованию химической связи, является стремление атомов к завершению внешнего уровня. Образование химической связи сопровождается выделением энергии, называемой энергией образования связи. Химическая связь образуется только в том случае, если при сближении атомов полная энергия системы (сумма кинетической и потенциальной энергий) понижается.
Рассмотрим простейшую молекулярную систему – молекулярный ион водорода Н2. В нем один электрон (ē) движется в поле двух ядер – протонов (рис.1). При сближении свободных атомов до расстояния меньше 0,02 нм, между ними начинают действовать силы притяжения, что сопровождается понижением потенциальной энергии. При дальнейшем сближении атомов притяжение усиливается (вплоть до 0,074 нм). В этот момент, силы притяжения уравновешиваются силами отталкивания и потенциальная энергия принимает минимальное значение Е0. При R< R0 силы отталкивания резко возрастают. Это приводит к быстрому увеличению потенциальной энергии и атомы водорода возвращаются к наиболее устойчивому положению. Графически это выражается наличием минимума на кривой. Величина минимума называется “потенциальной ямой” - характеризует прочность образовавшейся молекулы и называется энергией химической связи.
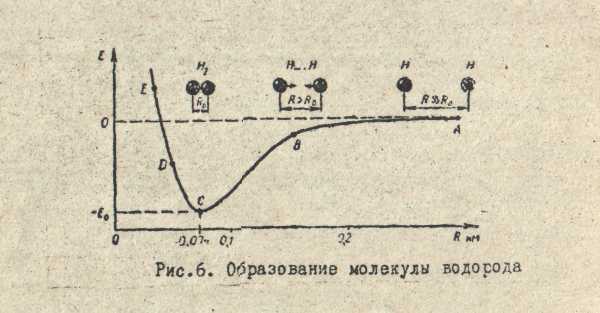
рис.1
Точно определить положение электрона в молекуле невозможно. Но можно рассмотреть вероятность его нахождения в пространстве относительно ядер (рис. 2). Так, в любой момент времени электрон может оказаться в положении (б). В другой момент электрон будет находится в новом положении, например в (в). Когда электрон находится в положении (б), то его притяжение к протонам способствуют их сближению. Когда же имеет место конфигурация (в), то силы притяжения направлены в одну сторону и отталкивание протонов не компенсируют.
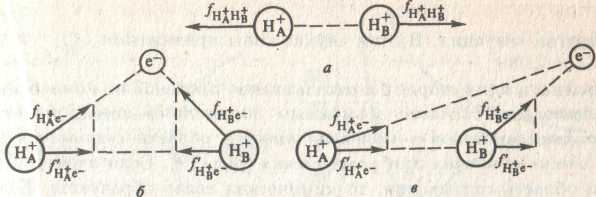
|
рис.2
Следовательно, согласно возможным положениям электрона относительно двух протонов в молекуле имеется область связывания и область разрыхления (рис. 3).
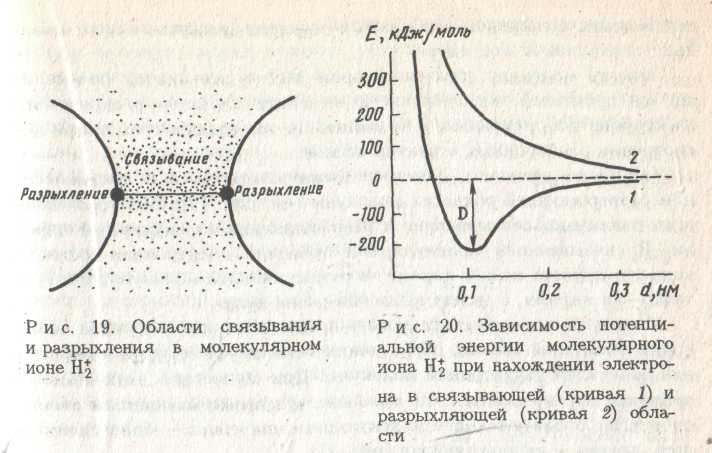
рис. 3
Если электрон попадает в область связывания, то хим. связь образуется. Если же электрон попадает в область разрыхления, то хим. связь не образуется. Т.е. хим. связь возникает в том случае, если электрон оказывается в пространстве между ядрами (в связывающей области).
Природа химической связи объясняется взаимодействием электрических полей, создаваемых электронами и ядрами атомов, которые участвуют в образовании связи.
Различают три основных типа химических связей: ионную, ковалентную, металлическую.
Для приблизительной оценки ионности связи используют эмпирическую зависимость ионности от разности относительных электроотрицательностей (∆ ОЭО) атомов, образующих связь:
− ∆ ОЭО > 1,7 – преобладает ионная связь;
− ∆ ОЭО от 0,5 до 1,7 – ковалентная полярная связь;
− ∆ ОЭО < 0,5 – ковалентная неполярная.
Механизм образования ковалентной связи, ее виды и свойства. Ковалентная связь осуществляется за счет общих электронных пар, принадлежащих обоим атомам, которые могут быть получены двумя способами: 1) каждый из атомов отдает на общее пользование по одному электрону (обменный механизм); 2) один атом отдает в общее пользование два электрона (донор), а другой (акцептор) – вакантную орбиталь для этой пары (донорно-акцепторный механизм).
Для описания и расчета обменной ковалентной связи широко используются два метода – метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Основные положения МВС базируются на квантово – механической теории строения атома. С точки зрения этого метода:
1. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных орбиталей и между атомами появляется область с повышенной электронной плотностью, обуславливающая связь между ядрами атомов.
2. Химическая связь образуется в том направлении, где возможность перекрывания атомных орбиталей наибольшая. Чем больше перекрываются атомные орбитали, тем больше выделяется энергия и тем прочнее связь.
Ковалентная обменная связь может быть неполярной (возникает между атомами одного и того же элемента или между разными атомами, которые имеют близкие электроотрицательности) или полярной (образуется между атомами, имеющими различные значения электроотрицательностей). Пример: Определить тип связей и составить электронные схемы молекул CS2 HCl.
Метод молекулярных орбиталей (ММО). Согласно теории ММО молекула рассматривается как совокупность положительно заряженных ядер и отрицательно заряженных электронов, где каждый электрон движется в поле остальных электронов и всех ядер.
Описать молекулу согласно теории МО - это значит определить тип ее орбиталей, их энергию и выяснить характер распределения электронов по орбиталям.
Основные положения теории МО:
1. При образовании молекул из атомов происходит обобществление всех электронов. Молекула рассматривается как единое целое. Путем наложения электронных облаков (или АО) возникают новые комбинированные облака, уже являющимися общими для всей молекулы в целом. Это молекулярные орбитали(МО).
2. Чтобы АО могли взаимодействовать с образованием МО, они должны:
- быть близкими по энергии;
- заметно перекрываться;
- обладать одинаковой симметрией относительно образуемой хим. связи.
3. АО, превращаясь путем взаимного положения в молекулярные, как бы перерождаются. При этом происходит изменение энергетического состояния всей молекулярной системы.
Электрон может находится в связывающей или разрыхляющей областях молекулы. В соответствии с этим различают связывающие (Ψ) и разрыхляющие (Ψ*) орбитали. Cвязывающие электроны непосредственно участвуют в образовании хим. связи, а разрыхляющие - ослабляют ее. Вероятность пребывания электрона в МО(связ.) высокая, а в разрыхляющей МО - низкая. Поэтому электроны при образовании молекулы занимают связывающие МО, а уж затем - разрыхляющие. Хим. связь возникает только тогда, когда число электронов на связывающей орбитале больше, чем на разрыхляющей.
Образование молекулярных орбиталей из атомных изображают в виде энергетической диаграммы, где по вертикале откладывают значения энергии орбиталей. Слева и справа на диаграмме приводят энергетические уровни АО, в середине уровни МО (рис. 4).
Схема образования молекулы Н2
Е Ψ *
Ψ 1S Ψ 1S
Ψ
рис. 4
При достаточном сближении атомов водорода, происходит перекрывание их АО. Из двух одинаковых 1S - орбиталей образуются 2 МО: МО(связ. Ψ) и МО(разрых. Ψ*), а находящиеся на них электроны называют соответственно связывающими и разрыхляющими.
Донорно-акцепторная связь
Механизм образования ковалентной связи за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторной связью.
Например: В ионе аммония NH 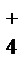 три связи ковалентных полярных и одна донорно-акцепторная.
три связи ковалентных полярных и одна донорно-акцепторная.
Н Н +
H : :
:  + H+ → H :
+ H+ → H :  :H
:H
Н Н
донор акцептор
Дата добавления: 2016-01-03; просмотров: 1842;
