Углерод и его соединения.
Большая часть углерода находится в виде карбонатов кальция и магния, нефти, каменного т бурого угля, природного газа. В атмосфере содержание углекислого газа составляет 0,03%. Углерод входит в состав всех живых тканей. В свободном состоянии углерод встречается в виде графита и алмаза. Древесный уголь и некоторые другие разновидности углерода представляют собой микрокристаллические формы графита.
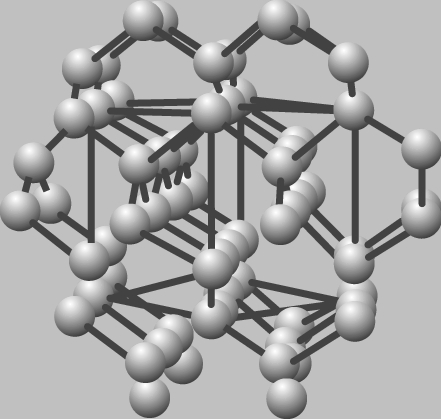
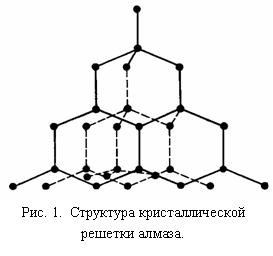
Алмаз обладает структурой, в которой каждый атом С окружен по тетраэдру четырьмя другими атомами С. Между атомами С образуются прочные ковалентные связи. Элементарная ячейка структуры – кубическая.
Алмаз
Алмаз обладает высокой температурой плавления (около 3930ºС) и превосходит другие вещества по твердости. Благодаря прочности, прозрачности, высокому коэффициенту преломления света, алмаз является одним из наиболее ценных ювелирных камней и очень эффективным абразивным материалом. Примеси окрашивают алмаз в различные цвета.
Превращения алмаза в графит имеют высокую энергию активации, поэтому алмаз устойчив при обычных условиях. Искусственные алмазы получают из графита при высоких температурах и давлении, в присутствии катализатора.
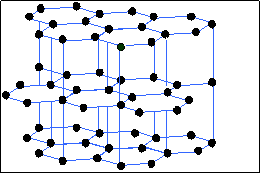
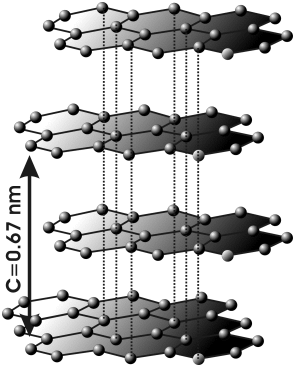
Графит. Образует плоские двухмерные слои из атомов С, соединенных между собой в гексанальные кольца. Между атомами С в слоях образуются σ-связи за счет перекрывания sp2 –гибридных орбиталей углерода, при этом каждый атом С имеет по три соседних атома С. У каждого атома С остается по одной р-орбитали, которые ориентированы перпендикулярно плоскости слоя. Эти орбитали образуют π-связи, делокализованные в плоскости слоя.
 Графит
Графит
Между слоями графита существуют слабые связи. Расстояние между слоями значительно больше, чем между атомами С в слое. Поэтому слои структуры легко сдвигаются относительно друг друга, что делает графит мягким и пластичным. Графит в отличие от алмаза проявляет электропроводные свойства. Особенность электропроводности графита заключается в том, что она проявляется вдоль слоев его структуры. Благодаря этому свойству графит применяется для изготовления электродов.
Фуллерены. Представляют собой большие кластеры атомов С, например фуллерены С60 и С70. Молекула С60 напоминает по форме покрышку футбольного мяча, которая «сшита» из пяти-, и шестичленных колец, при этом каждый атом С проявляет координационное число, равное трем.

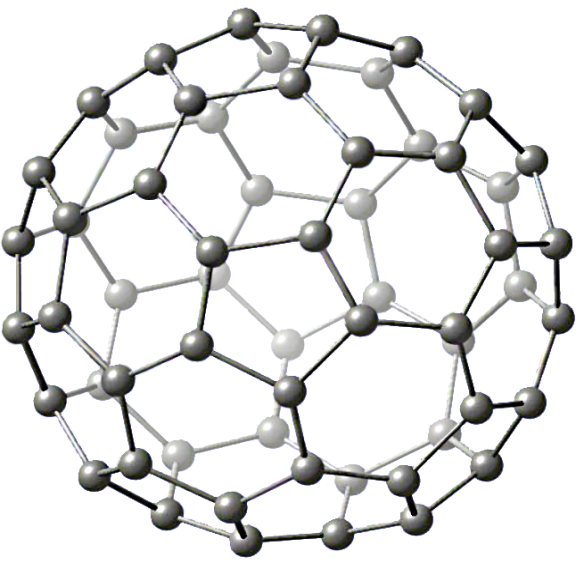
Фуллерены
Для синтеза фуллеренов используют газофазный метод, при котором графит испаряется, с помощью лазера, а из газовой фазы формируются кластеры углерода.
Фуллерены способны полимеризоваться (сшивание между собой сферических каркасных элементов). На основе таких полимеров планируется создать источники тока и аккумуляторы с высокой электронной «емкостью». Включение атомов металлов внутрь оболочки фуллеренов делает их металлическими проводниками, а при низких температурах – сверхпроводниками.
Помимо графита и алмаза существует еще две аллотропные модификации – карбин и поликумулен, получены они искусственно и представляют собой линейные цепные полимеры.
Дата добавления: 2016-01-03; просмотров: 2378;
