Квантовые числа электронов
Строение атома. Двойственная природа электрона. Строение электронных оболочек атомов. Квантовые числа. Атомные орбитали. Электронные конфигурации атомов в основном и возбужденном состояниях, принцип Паули, правило Гунда
Теория Бора
Модель строения атома, предложенная Резерфордом, подразумевала, что электрон — сугубо материальная частица, имеющая массу и заряд и подчиняющаяся законам классической физики. Но уже в самой модели были заложены противоречия с этими законами, т.к. в классической физике невозможно безызлучательное движение заряженной частицы.
Первым шагом для преодоления этих противоречий стала модель Н. Бора, основывавшаяся также на законах классической физики, но с привлечением представлений новой в те времена, но интенсивно развивающейся науки — квантовой механики.
Для построения своей модели атома Бор ввел два постулата, согласно которым
1) Движение электрона вокруг ядра происходит по так называемым стационарным орбитам и описывается уравнением:
mvr=nh/2p
где т — масса электрона, v — его скорость, r — радиус стационарной орбиты, n — натуральное число, соответствующее номеру орбиты, a h — константа, называемая постоянной Планка, h=6,62•10-34 Дж•с.
2) Движение электрона по стационарной орбите происходит без излучения и поглощения энергии.
Каждой стационарной орбите соответствует определенное энергетическое состояние электрона. Электрон может переходить с одной стационарной орбиты на другую, но это требует поглощения или испускания порции (кванта) энергии. Переход электрона с орбиты с номером n, которой соответствует состояние с энергией en, на орбиту с номером k (состояние с энергией ek) требует поглощения (n<k) или испускания (n>k) энергии Denk, равной
по абсолютной величине разности энергий соответствующих состояний:
Denk=en-ek. Поскольку
Е=hv,
где v — частота излучения, то
Denk =h(nn- nk) = hnnk,
где nnk соответствует частоте того кванта энергии, который был поглощен или испущен электроном в процессе перехода с одной стационарной орбиты на другую.
Развитие квантовой механики изменило взгляды ученых на электрон. Оказалось, что ему присущ корпускулярно-волновой дуализм. Это значит, что электрон проявляет свойства как обычной частицы (имеет массу и заряд), так и свойства волны (способность к дифракции и интерференции). Квантовая механика оперирует сложнейшим математическим аппаратом, мы же остановимся лишь на некоторых выводах, необходимых для понимания строения атома и образования химической связи. Основной характеристикой волны является длина Д. Для электрона с массой т и скоростью v длина волны определяется соотношением де Бройля:
l=h/mv
Из дуалистичной природы электрона следует принцип неопределенности Гейзенберга, который постулирует невозможность одновременного точного определения местонахождения электрона и его скорости. Математически это выражается соотношением:
Dх•Dv>h/4pm
Dх — погрешность координаты, Dv — погрешность скорости, т — масса электрона. Физический смысл принципа неопределенности заключается в том, что чем с большей точностью мы знаем местонахождение электрона (координату), тем меньше точность в определении его скорости в данный момент времени.
Согласно принципам квантовой механики движение электрона в атоме не описывается уравнением Бора для орбиты. Электрон может находиться в любой точке пространства около ядра, но с разной вероятностью. Поэтому говорят об электронной плотности как о вероятности обнаружить электрон в какой-либо точке. С
понятием электронной плотности связано определение электронного облака, т.е. области пространства, внутри которой электронная плотность велика (вероятность более 90% ). Электронные облака имеют различную форму, которая определяется характером движения электрона около ядра. Характер движения электрона называется орбиталью. Орбиталь является больше энергетическим параметром, нежели пространственным.
Квантовые числа электронов
Квантовая теория подразумевает, что энергия электрона может принимать только определенные значения, т.е. квантуется. Энергия электрона, форма электронного облака и другие параметры описывают состояние электрона в атоме. Состояние электрона характеризуется совокупностью чисел, называемых квантовыми числами.
Главное квантовое число n служит для отнесения состояния электрона к тому или иному энергетическому уровню, под которым понимается набор орбиталей с близкими значениями энергии. Главное квантовое число может принимать любое значение из области натуральных чисел, т.е.n=1, 2, 3. При переходе электрона с одного энергетического уровня на другой главное квантовое число изменяется. (Можно сопоставить с переходом электрона с одной стационарной орбиты на другую в модели Бора.)
Энергетический уровень включает в себя несколько орбиталей. Орбитали с одинаковой энергией, принадлежащие одному энергетическому уровню, образуют энергетический подуровень. Отнесение орбитали к какому-либо подуровню производится при помощи побочного (орбитального) квантового числа l. Оно может принимать целочисленные значения от 0 до n-1. Т.е. для электрона с главным квантовым числом n орбитальное квантовое число l может принимать n значений от l=0 до l=n-1.Так, при n=1, l=0; при n=2, l=0 и l=1, при n=3, l=0, 1, 2. Число l входит в выражение для момента импульса электрона при его движении вокруг ядра:
p=hÖ(l((l+1))
Орбитальное квантовое число показывает, какому подуровню данного энергетического уровня соответствует характер движения рассматриваемого электрона. Очень часто состояния электрона обозначают латинскими буквами, при этом состояние с l=0 называют s-орбиталью, l=1 — р-орбиталью, l=2 — d-орбиталью l=3 — f-орбиталью, l=4 — g-орбиталью и т.д.
Электронные облака орбиталей с разными значениями l имеют разную конфигурацию, а с одинаковыми l похожую. Так,
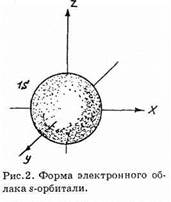
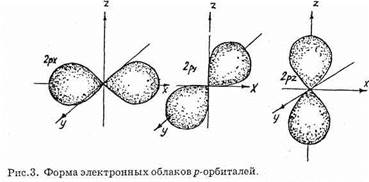
при l=0 (s-орбиталь) для электрона с любым значением главного квантового числа n электронное облако ограничено сферой (рис. 2), и чем больше n, тем больше ее радиус. Электронные облака p-орбиталей (l=1) имеют форму «вращающейся восьмерки» (рис. 3). При увеличении значения числа l формы электронных облаков усложняются. Соответственно увеличивается энергия электрона, который занимает данную орбиталь.
Как видно из рисунка 3, орбитальному квантовому числу l=1 соответствуют три различным образом ориентированных в пространстве, но одинаковых по форме электронных облака (они называются рx, рy, рz-орбитали в соответствии с их расположением в пространстве). Вообще, на подуровне с орбитальным числом l находится 2l+1 орбиталь с одинаковой энергией.
Для того, чтобы различать электроны, занимающие одинаковые по энергии орбитали, введено магнитное квантовое число ml. Его квантово-механический смысл в том, что ml выражает проекцию орбитального момента импульса на направление магнитного поля. Именно магнитное квантовое число отражает пространственную ориентацию орбиталей с одинаковым числом l. Соответственно, для электрона с орбитальным квантовым числом l возможны 2l+1 различных значений магнитного квантового числа ml, от -l до +l, включая 0. Это значит, что, например, на третьем энергетическом уровне (n=3, l=0,1,2), при l=2 (d-подуровень)
электрон может находиться на 2 • 2 + 1 = 5 различных орбиталях с одинаковой энергией.
Четвертое квантовое число называется магнитным спиновым числом ms (или просто спином s) и характеризует чисто квантовое свойство электрона — спин. Спин электрона есть собственный момент количества движения. Хотя интерпретация этого свойства сложна, его можно уподобить вращению электрона вокруг своей воображаемой оси. Магнитное спиновое число ms может быть равно либо (-1/2), либо (+1/2)1.
Электронные конфигурации атомов
Итак, атом состоит из ядра и электронов, определенным образом распределенных в околоядерном пространстве. При этом электроны находятся на некотором конечном расстоянии от ядра. Между ядром (положительный заряд) и электронами (заряжены отрицательно) действуют силы электростатической природы . Поэтому чем меньше расстояние между электроном и ядром, тем больше энергия взаимодействия между ними. Поскольку полную энергию электрона определить чрезвычайно сложно, то условились считать, что его потенциальная энергия равна нулю, если электрон бесконечно удален от ядра. Используя это состояние как начало отсчета, определяют относительную энергию электрона.
Электроны образуют электронную оболочку атома. Электронная оболочка представляет собой набор энергетических уровней. Принадлежность электрона к какому-либо энергетическому уровню определяется главным квантовым числом п. Вообще, атом содержит бесконечно много энергетических уровней (n=1, 2, 3,...), но не все из них заполнены электронами. При заполнении электронной оболочки атома выполняется принцип наименьшей энергии, т.е.

1 Вообще, абсолютное значение спина для любого электрона равно S=1/2, а число ms обозначает проекцию спина на ось г. Иногда число S тоже включают в набор квантовых чисел.
2 По закону Кулона сила взаимодействия двух зарядов пропорциональна произведению зарядов и обратно пропорциональна квадрату расстояния между ними.
Именно основные состояния мы будем иметь в виду при рассмотрении заполнения электронных оболочек атомов.
Согласно принципу наименьшей энергии, сначала заполняется энергетический уровень с n=1, затем, после заполнения первого уровня, с n=2 и т.д. Всего на первом уровне (n=1) может находиться только два электрона, на втором (n=2) восемь, на третьем (га = 3) восемнадцать, т.е. на уровне с номером n может находиться не более 2n2 электронов. Это следует из другого правила, которое выполняется при построении электронной оболочки атома и называется принципом Паули.

Поэтому на первом уровне (n=1,l=n-1=0, орбиталь s-типа) электроны могут различаться только значением спинового числа ns, а поскольку для него возможны только два значения (-1/2 и +1/2), то первый энергетический уровень может быть занят не более чем двумя электронами. Заполнение этого уровня происходит в невозбужденных атомах водорода и гелия. Схематично это можно представить следующим образом:

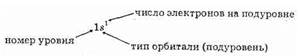
Клеточка обозначает орбиталь, а стрелки — электроны, при этом направление стрелки указывает спин. Если две стрелки имеют одинаковое направление, то это значит, что эти два электрона имеют одинаковые спины (магнитное спиновое число ms для обоих электронов имеет значение либо -1/2, либо +1/2). Разнонаправленными стрелками обозначают электроны, у одного из которых ms=-1/2, а у другого ms = +1/2. Символами 1s1 и 1s2 обозначена электронная конфигурация атомов, которая показывает, что в атоме водорода единственный электрон занимает 1s-орбиталь, а в атоме гелия на 1s-орбитали располагаются два электрона.
Когда мы переходим на второй электронный уровень (главное квантовое число 2), или, что то же самое, к элементам второго периода, появляется возможность размещения электронов не
только на s , но и на р -орбиталях (квантовое число 1 может принимать значение 0 и 1). Электронные оболочки лития и бериллия заполняются так же, как для водорода и гелия

В атоме бора появляется первый электрон на р-орбитали.
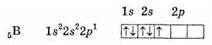
Следующий электрон (в атоме углерода) можно разместить на той же px-орбитали (его спин будет противоположным, и принцип Паули не будет нарушен), но можно и на другой (py-орбиталь), поскольку их энергия одинакова. Реально в атоме углерода электрон размещается именно на py-орбитали. Размещение электронов на орбиталях с одинаковой энергией определяется правилом Гунда:

Это правило можно переформулировать по другому — на орбиталях с одинаковой энергией электроны размещаются так, чтобы имелось максимальное число неспаренных электронов. В соответствии с этим правилом в атоме углерода и в атомах следующих элементов второго периода:

При переходе к третьему уровню (к элементам третьего периода) появляются три типа орбиталей s, p, и d-орбитали. Заполнение орбиталей первых восьми элементов происходит так же, как в случае второго периода. Далее можно было бы ожидать заполне-
ния d-орбиталей, однако после аргона (как видно из таблицы Менделеева) появляется калий — элемент четвертого периода. Почему? Энергия электрона на орбитали определяется (что очевидно из ранее сказанного) как главным квантовым числом n, так и побочным l. Соответственно работает следствие из принципа наименьшей энергии, называемое правилом Клечковского:
Если бы в атоме калия последний электрон занял 3d-орбиталь, то значение указанной суммы было бы 3(n=3)+2(l=2)=5, но он занимает 4s-орбиталь, и сумма составляет 4(n=4)+0(l=0) = 4. То же происходит со следующим электроном в атоме кальция. Однако далее более выгодным становится заполнение 3d-орбиталей, и атом скандия открывает ряд переходных элементов 4-го периода, в которых заполняются 10 вакансий Sd-орбиталей. Схема заполнения орбиталей отражена на рис. 4.
Правило Клечковского не абсолютно, так как не учитывает, что спаренные электроны имеют большую энергию, чем неспаренные (что составляет основу правила Гунда). Так, в атоме хрома, кроме появления очередного электрона на 3d-орбитали, на ту же орбиталь переходит один из 4s-электронов (так называемый «проскок электрона»). В следующем атоме марганца этот электрон возвращается обратно.
Напоминаем, что все сказанное относится к основному состоянию атома. В возбужденном состоянии (когда атому придана дополнительная энергия) работает только принцип Паули.
Используя изложенные выше правила, вы всегда сможете составить электронную формулу любого элемента в его основном состоянии.
Электронные формулы
Распределение электронов в атоме по энергетическим уровням и подуровням изображают в виде электронных формул. Рассмотрим, как они составляются.
Напоминаем! Каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией, отвечающей его прочной связи с ядром, — принцип наименьшей энергии. С ростом порядкового номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергии, а подуровни — в последовательности s-p-d-f. Последовательность возрастания энергии называется шкалой энергии. В соответствии с ней составляют ряд последовательного заполнения электронами орбиталей атомов

Рис.4. Схема заполнения электронами энергетических уровней и подуровней.
элементов периодической системы. Этот ряд, в котором вертикальными линейками отделены периоды, обозначенные сверху цифрами, имеет вид (см. рис, 4).

Орбиталь с минимальной энергией — это 1s-орбиталь. У атома водорода она занята его единственным электроном. Поэтому электронная формула (или электронная конфигурация) атома водорода имеет вид:
Так как на одной орбитали могут находиться два электрона, то оба электрона атома гелия размещаются на 1s-орбитали. Сле-
довательно, электронная формула атома гелия 1s2 . Электронная оболочка Не завершена и очень устойчива, это благородный газ.
У атомов элементов второго периода заполняется L-уровень (n=2), причем вначале орбиталь s-подуровня, а затем три орбитали р-подуровня. Электронная формула атома лития 3Li: 1s22s1 Электрон 2s1 намного слабее связан с ядром атома, чем 1s-электроны, поэтому атом лития может легко терять его, образуя ион Li+.
В атоме 4Ве четвертый электрон также размещается на 2s-орбитали: 1s22s2. Легче других электронов у Be отрываются два 2s-электрона с образованием иона Ве2+
Поскольку 2s-орбиталь заполнена, то пятый электрон у атома бора 5В занимает 2р-орбиталь. Электронная формула атома бора 5В: 1s22s2p1.
Далее у атомов С, N, О, F идет заполнение 2р-орбиталей, которое заканчивается у атома Ne (см. стр. 30).
Начиная с элементов третьего периода у атомов идет заполнение третьего М-уровня, состоящего из 3s-, Зр- и Зd-подуровней.
Например: 11Na: 1s22s22p63s1
]7Сl: 1s22s22p63s23p5
Иногда в формулах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне. Тогда их записывают так:
11Na = 2. 8. 1; 17Сl — 2. 8. 7; 26Fe —2. 8.14. 2.
При написании электронных формул следует учитывать так называемый «проскок» электрона. Так, электронная формула хрома должна быть 1s22s22p63s23p63d44s2. Однако на внешнем уровне у атома хрома не два электрона, а один: второй электрон « проскочил » на d-подуровень второго снаружи уровня (см. Принцип наименьшей энергии). В таком случае расположение электронов у атома хрома такое: 1s22s22p63s23p63d54s1. To же имеет место у Nb, Mo и других элементов. У Pd электроны по уровням располагаются так: 2. 8. 18. 18. 0 (здесь пятый энергетический уровень вообще отсутствует: оба электрона «проскочили» на соседний уровень).
Часто структуру электронных оболочек изображают с помощью энергетических, или квантовых, ячеек — это так называемые графические электронные формулы (ячейки Гунда).
В качестве примера рассмотрим схему распределения электронов по квантовым ячейкам в атоме углерода:

(возбужденное, неустойчивое состояние)
Напоминаем!
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку в 2р-подуровне три орбитали с одинаковой энергией, то каждый из двух 2р-электро-нов занял по одной орбитали (например, рх, ру). Одна орбиталь осталась свободной (рz). У атома углерода в устойчивом состоянии два неспаренных электрона. В возбужденном атоме углерода четыре неспаренных электрона. Слева от схем — в электронных формулах даны более подробные записи с указанием расположения электронов на рx-py-pz-орбиталях. Эту запись тоже часто применяют.
Часто постоянную Планка обозначают ћ=h/2p=1,05•10-34 Дж•c
Неважно, какому направлению стрелки соответствует спин -1/2, а какому +1/2. Главное, чтобы электроны с одинаковыми спинами обозначались одинаковыми стрелками
| <== предыдущая лекция | | | следующая лекция ==> |
| | | Концентраторы и сетевые адаптеры |
Дата добавления: 2016-01-03; просмотров: 5231;
