Ферриты. Комплексные соединения железа
Для железа наиболее характерны два ряда соединений: соединения железа (II) и железа (III). Известно также небольшое число соединений железа (VI).
Оксид железа (II) FeO — черный, легко окисляющийся порошок. Получают его восстановлением оксида железа (III) оксидом углерода (II) при 500°С:
Fe2O3+СО=2FeO+СО2
FeO проявляет свойства основного оксида: легко растворяется в кислотах, образуя соли железа (II):
Оксид железа (III) Fe2O3 — самое устойчивое природное кислородсодержащее соединение железа.
Является амфотерным оксидом. При сплавлении Fe2O3 с оксидами, гидроксидами или карбонатами металлов образуются ферриты:
Fe2O3+2NaOH=2NaFeO2+Н2О Fe2O3+Na2CO3=2NaFeO2+CO2
Растворяясь в кислотах, оксид железа (III) образует соли железа(III):
Fe2O3+6НСl=2FeCl3+3Н2О
Оксид железа (II-III) Fe3O4 встречается в природе в виде минерала магнетита. Он хороший проводник тока, поэтому используется для изготовления электродов.
Получают взаимодействием железа с водяным паром ниже 570°С:
3Fe+4Н2O=Fe3O4+4H2
Оксид железа (II-III) Fe3O4 иным образом можно записать как FeO•Fe2O3.
Оксидам соответствуют гидроксиды железа.
Гидроксид железа (II) Fe(OH)2 представляет собой твердое вещество, но в чистом виде его можно получить лишь тогда, когда растворы реагирующих веществ не содержат растворенного кислорода и если реакцию вести в отсутствие кислорода воздуха:
FeSO4+2NaOH=Fe(OH)2¯+Na2SO4
На воздухе гидроксид железа (II) неустойчив, при соприкосновении с ним сначала зеленеет, затем буреет, переходя в гидроксид железа (III):
4Fe(OH)2+О2+2Н2O=4Fe(OH)3
Гидроксид железа (II) Fe(OH)2 является нерастворимым гидроксидом и проявляет основные свойства, хорошо растворяясь в минеральных кислотах и образуя соли железа (II):
Fe(OH)2+H2SO4=FeSO4+2Н2О
Гидроксид железа (III) Fe(OH)3 в виде красно-бурого осадка может быть получен окислением Fe(OH)2 либо действием щелочей на соли железа (III):
FeCl3+3NaOH=Fe(OH)3¯+3NaCl
Гидроксид железа (III) трудно растворим, является более слабым основанием, чем гидроксид железа (II). Это объясняется тем, что у Fe2+ меньше заряд иона и больше его радиус, чем у Fe3+, a значит, Fe2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH)2 более легко диссоциирует. Гидроксид железа (III) обладает слабовыраженной амфотерностью: растворяется в разбавленных кислотах:
Fe(OH)3+3НСl=FeCl3+3Н2О
а при сплавлении со щелочами или основными оксидами образует ферриты:
Fe(OH)3+3NaOH=NaFeO2+2Н2О
Соли двухвалентного железа могут быть получены растворением металлического железа, гидроксида, карбоната или сульфида железа (II) в разбавленных кислотах без доступа воздуха:
Fe+2НСl=FeCl2+Н2О
Соли железа (II)гидролизуются незначительно: Fe2++Н2О«Fe(OH)++Н+
Среди солей железа (II) наибольшее значение имеет железный купорос FeSO4•7Н2О, в состав которого входит семь молекул кристаллизационной воды. Железный купорос хорошо растворяется в воде. Его применяют для борьбы с вредителями сельского хозяйства, а также для изготовления красителей.
Соли трехвалентного железа могут быть получены окислением порошка железа галогенами, окислением солей железа (II), растворением оксида или гидроксида железа (III) на воздухе:
2Fe+3Cl2=2FeCl3
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Соли железа (III) сильно гидролизуются водой, и их водные растворы имеют кислую реакцию:
FeCl3+НОН«Fe(OH)Cl2¯+HCl Fe3++НОН«Fe(OH)2++Н+
Из солей железа (III) наибольшее значение имеют хлорид железа (III) FeCl3, представляющий собой весьма гигроскопические оранжевые кристаллы, которые при хранении поглощают воду и расплываются в коричневую кашицу; ионагидрат сульфата железа (III) Fe2(SO4)3•9Н2О, используемый как коагулянт, а также для травления металлов; ионагидрат нитрата железа (III) Fe(NO3)3•9Н2О, используемый как протрава при крашении хлопчатобумажных тканей и утяжелитель шелка.
Соли железа (II) легко переходят в соли железа (III), например, при нагревании с азотной кислотой или с перманганатом калия в присутствии серной кислоты:
6FeSO4+2HNO3+3H2SO4=3Fe2(SO4)3+2NO+4H2O
Окисление солей железа (II) в соли железа (III) может происходить под действием кислорода воздуха при хранении этих соединений, но только этот процесс очень длительный.
Кроме того, следует отметить также две важные комплексные соли, в которых железо входит в состав анионов: гексацианоферрат (II) калия K4[Fe(CN)6] и гексацианоферрат (III) калия K3[Fe(CN)6], которые являются реактивами на катионы Fe3+ и Fe2+ соответственно.
Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная кровь) является важным реактивом для обнаружения ионов железа Fe3+ в растворе:
K4[Fe(CN)6]« 4К++[Fe(CN)6]4-
Получающиеся ионы [Fe(CN)6]4- могут взаимодействовать с ионами Fe3+, образуя характерный темно-синий осадок гексацианоферрата (II) железа (III), называемый часто берлинской лазурью:
3[Fe(CN)6]4-+4Fe3+=Fe4[Fe(CN)6]3¯
Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) является реактивом на катионы Fe2+:
K3[Fe(CN)6]«3K++[Fe(CN)6]3-
и при взаимодействии иона [Fe(CN)6]3- с катионами Fe2+ выпадает темно-синий осадок гексацианоферрата (III) железа (II), называемый часто турнбулевой синью:
2[Fe(CN)6]3-+Fe2+=Fe3[Fe(CN)6]2¯
Катионы Fe3+ могут быть обнаружены также с помощью бесцветного раствора роданида аммония NH4SCN:
NH4SCN«NH4++SCN-
Ионы SCN- образуют с катионом Fe3+ соединение кроваво-красного цвета — роданит железа Fe(SCN)3 (плохо диссоциирующий):
Fe3++3SCN-=Fe(SCN)3
Известно также небольшое число соединений железа (VI) — ферраты, например феррат калия K2FeO4, феррат бария BaFeO4, которые могут быть получены окислением оксида железа (III) при нагревании с нитратом и гидроксидом калия:
Fe2O3+4КОН+3KNO3=2K2FeO4+3KNO2+2H2O или при легком нагревании с бромом и щелочью:
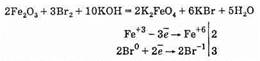
Ферраты в окислительно-восстановительных реакциях могут быть только окислителями.
Дата добавления: 2016-01-03; просмотров: 9841;
