Тепловой эффект химической реакции
При протекании любых химических реакций (по определению) происходит разрыв одних химических связей и образование других. Поскольку чрезвычайно маловероятно, что суммарные энергии всех разорванных и всех образованных связей окажутся равными, то практически все реакции проходят с выделением или поглощением энергии. Энергия может выделяться или поглощаться в виде звуковых волн, света, работы расширения и сжатия и т.п. Однако в большинстве случаев она выделяется или поглощается в виде тепла.
Реакции, в которых выделяется тепло, называются экзотермическими, реакции, в которых оно поглощается, — эндотермическими. Количество выделенного или поглощенного в ходе реакции тепла называется тепловым эффектом химической реакции и обозначается обычно символом Q. Эта величина может быть измерена на опыте, а уравнение соответствующей химической реакции записано в виде
a1A1+а2А2+а3А3+ ...=b1B1+b2В2+b3В3 + ... ±Q
Знак, стоящий перед величиной теплового эффекта, показывает, выделяется тепло (+) или поглощается (-). Такая форма записи называется термохимическим уравнением. Величина Q в таком уравнении указывается для того количества реагентов, которое указано стехиометрическими коэффициентами. В термохимических уравнениях часто используют дробные коэффициенты, чтобы хотя бы один из реагентов имел коэффициент 1.
В случае, когда в ходе реакции меняется объем (например, при выделении или поглощении газов) тепловой эффект зависит от того, проводится реакция при постоянном объеме или постоянном давлении (то есть от того, совершается работа или нет). Поэтому для общности тепловые эффекты указываются для реакций при постоянном объеме. При этом тепловой эффект реакции совпадает по величине и противоположен по знаку разнице энтальпии (DH) продуктов реакции и исходных веществ.
Q=-DH
Энтальпия Н — это функция состояния вещества, то есть определенное его свойство, постоянное для одного количества одного и того же вещества при одних и тех же условиях. Она является мерой внутренней энергии вещества при постоянном объеме. Соответственно изменение энтальпии в реакции является численной характеристикой разницы внутренней энергии продуктов реакции и исходных веществ.
При экзотермических реакциях (тепло выделяется) DH отрицательно, при эндотермических - положительно. С использованием величины изменения энтальпии термохимические уравнения записываются следующим образом:
Н2+Сl2=2НСl, DH=-184.6 кДж
В справочных таблицах приводятся энтальпии образования веществ при стандартных условиях (Т=298 К, P=105 Па).

Из этого определения следует, что энтальпия образования простых веществ (в наиболее стабильных аллотропных модификациях) всегда равна нулю.
При написании термохимических уравнений всегда указывается агрегатное состояние вещества, поскольку энтальпия образования одного и того же вещества различна для различных его агрегатных состояний. Так, для образования воды:
Н2(г)+1/2O2(г)=Н2O(ж), DH=DHобр(H2O)=-286 кДж/моль
H2(r)+1/2O2(г)=Н2O(г), DH=DHобр(Н2O(г))=-242 кДж/моль
Зная энтальпии образования (или теплоты образования) исходных и конечных веществ в химической реакции, можно определить изменение энтальпии (тепловой эффект) для нее. Для этого используется главный закон термохимии — закон Гесса:

Рассмотрим для примера реакцию образования углекислого газа. Можно окислить графит кислородом:
C(граф)+O2(г)=СO2(г) (DH1) (1)
А можно сначала получить из графита алмаз, а потом окислить его
С(граф)=С(алм) (DH2) (2)
С(алм)+О2(г)=СO2(г) (DH3); (3)
Закон Гесса утверждает, что поскольку исходные и конечные вещества в реакции (1) и в последовательности реакций (2) и (3) одинаковы и находятся в одинаковом состоянии, то DH1=DH2+DH3
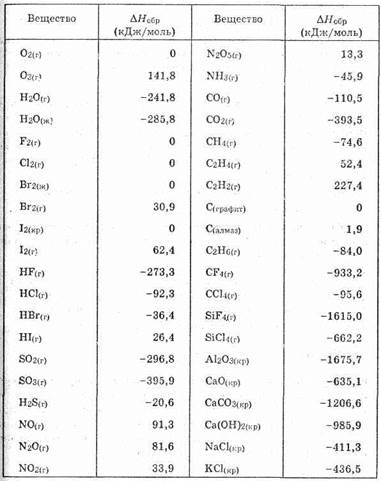
Это очень важно для тех случаев, когда прямое измерение теплоты реакции невозможно. Так, очень сложно определить изменение энтальпии реакции (2), поскольку она проходит при Огромных температуре и давлении, но довольно просто для первой (DH1=-393,0 кДж/моль) и третьей (DH3=-394,9 кДж/моль). Тогда по закону Гесса
DH2=DH1-DH3=-393,0 кДж/моль-(-394,9 кДж/моль)=1,9 кДж/моль
Для такого рода расчетов удобно пользоваться очевидным следствием закона Гесса (иногда именно его называют законом Гесса, что неверно):

DHреакции=SiniDHi-SjnjDHj,
где DHi — это энтальпии образования продуктов, ni — их стехиометрические коэффициенты в уравнении реакции, DHj и nj — то же самое для исходных веществ. Такое же выражение можно написать для теплового эффекта реакции и теплот образования (заменив везде DH на Q). Стандартные энтальпии образования некоторых веществ приведены в таблице 9.
Таблица 9.
Энтальпии образования при 25 °С (298 К)
| <== предыдущая лекция | | | следующая лекция ==> |
| Защита ПА от теплового излучения пожаров | | | Мониторинг инновационного проекта |
Дата добавления: 2016-01-03; просмотров: 628;
