КЛАССИФИКАЦИЯ ЭЛЕКТРОМАТЕРИАЛОВ
СТРОЕНИЕ ВЕЩЕСТВА
ВИДЫ СВЯЗИ
Все вещества состоят из атомов.
Атом представляет собой систему, состоящую из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Электроны притягиваются к ядру и отталкиваются друг от друга. Расположенные ближе к ядру электроны подвержены большему притяжению, они ослабляют притяжение внешних электронов, которые находятся на большем расстоянии от ядра. Внешние электроны могут отрываться от одного атома и присоединяться к другому атому, изменяя число его внешних электронов. Такие электроны называются валентными. У разных веществ атомы содержат разное число валентных электронов.

| а | б |
Рис. 1.1. Ковалентная (атомная) связь в молекуле водорода:
а - изолированные атомы; б - молекула с ковалентной связью
Атом, потерявший один или несколько электронов, становится положительно заряженным. Атом, который присоединил к себе свободные электроны, становится отрицательно заряженным. Образовавшиеся таким образом положительные и отрицательные частицы называются ионами.
Из атомов строятся молекулы. Связи, благодаря которым происходит объединение атомов в молекулы, называются химическими.
Способность атомов вступать в соединения с атомами других веществ и образовывать молекулы определяет химические свойства вещества.
Молекула является наименьшей частицей вещества, которая сохраняет его химические свойства.
Химические связи между атомами вещества делят на ковалентные (атомные), ионные, металлические и молекулярные.
1) Ковалентная
Ковалентные связи возникают между атомами за счет образования устойчивых пар валентных электронов разных атомов (рис. 1.1).
Эти пары являются общими для атомов, которые входят в молекулу. Если двухатомная молекула состоит из атомов одного элемента (Н2, Сl2, N2), то электронная пара в одинаковой степени принадлежит обоим атомам. В таком случае молекулу и ковалентную связь называют неполярными и (или) нейтральными. В неполярных молекулах центры положительных и отрицательных зарядов совпадают.
Если двухатомная молекула состоит из атомов различных элементов, то электронная пара может быть смещена к одному из атомов. В этом случае ковалентную связь называют полярной, а молекулы с полярной связью, у которых центры положительных зарядов не совпадают, - полярными или дипольными. Дипольная молекула характеризуется электрическим дипольным моментом
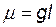
где g - абсолютное значение заряда, Кл; l – расстояние между центрами положительного и отрицательного зарядов, м.
Если у многоатомных молекул заряды расположены симметрично, то они неполярны, при несимметричном расположении атомов молекулы полярны (рис. 1.2).
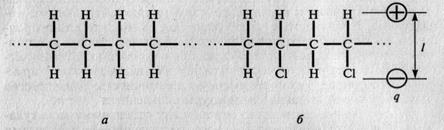
Рис. 1.2. Схемы неполярной молекулы полиэтилена (  ) (а) и полярной молекулы поливинилхлорида (б): q - абсолютное значение заряда; l - расстояние между центрами положительного и отрицательного зарядов
) (а) и полярной молекулы поливинилхлорида (б): q - абсолютное значение заряда; l - расстояние между центрами положительного и отрицательного зарядов
Атомная связь имеет направленный характер. Эта связь образуется в направлении наибольшей плотности объединенных электронов. Поэтому вещества с ковалентными связями обычно характеризуются твердостью, хрупкостью, тугоплавкостью и химической инертностью. К ним относятся кристаллы германия, кремния, алмаза, соединения элементов из средних групп таблицы Д.И.Менделеева - SiC, BN. Атомные связи характерны для таких газов, как Н2, О2, N2. Молекулы некоторых органических соединений: полиэтилена (С2Н4)n, политетрафторэтилена (C2F4)n -имеют ковалентную связь, при этом между отдельными молекулами в этих материалах образуются молекулярные связи.
Разновидностью ковалентной связи является донорно-акцепторная связь, которая возникает между атомом, способным отдать электрон (донор), и атомом, способным принять этот электрон (акцептор). Примером таких материалов являются соединения мышьяка -арсениды галлия GaAs и индия InAs.
2) Ионная
Ионные связи обусловлены силами электростатического притяжения между положительными и отрицательными ионами.
Молекулы вещества с полярной связью полярны. Не имеют направленности. Соединения с ионной связью обладают разными свойствами, которые характерны для типичных металлов и неметаллов. Такие связи наиболее характерны для неорганических диэлектриков, которые имеют в своем составе ионы противоположных знаков (большинство солей и некоторые оксиды, например, ZnO, CdO, NiO, CuO2).
Ионные связи менее прочны, чем ковалентные, поэтому соединения, образованные ионной связью, уступают веществам с ковалентной связью по механической прочности и химической стойкости.
3) Металлическая
Металлические связи образуются в металлах и обусловлены особенностями поведения внешних (валентных) электронов. Атомы металлов обладают способностью отдавать внешние (валентные) электроны, превращаясь в положительный ион, или присоединять их вновь, превращаясь снова в нейтральный атом.
Внешние электроны, которые покидают атомы, становясь свободными, называются коллективизированными.
В результате металл представляет собой систему, состоящую из положительных ионов, которые находятся в среде коллективизированных электронов.

Рис.1.3. Металл в представлении теории электронного газа
В этой системе одновременно имеют место притяжение между ионами и свободными электронами и ковалентная связь между нейтральными молекулами. Наличие этих связей определяет монолитность и прочность металлов.
Благодаря наличию свободных электронов металлы обладают высокой электро- и теплопроводностью. Металлическая связь в отличие от ковалентной не имеет направленного характера, что придает металлам высокую пластичность. Большинство металлов имеют высокие температуры плавления и кипения.
4) Молекулярная
Молекулярные связи образуются между отдельными молекулами в результате электростатического притяжения между зарядами противоположных знаков, которые имеются в молекулах. Такое электростатическое притяжение называют силами Ван-дер-Ваалъса. С помощью таких сил образуются молекулы в твердом водороде Н2, азоте N2, углекислом газе СО2 и других органических соединениях - полиэтилене, фторопласте и др.
Особым видом молекулярной связи является водородная связь, которая образуется через ион водорода (протон), расположенный между двумя ионами соседних молекул. Водородной связью соединяются молекулы воды и некоторых органических соединений.
В твердых веществах атомы и молекулы располагаются в строгом порядке и хаотично. Вещества с закономерным упорядоченным расположением атомов или молекул в пространстве называют кристаллическими, а вещества с беспорядочным расположением атомов или молекул - аморфными.
КРИСТАЛЛИЧЕСКИЕ ВЕЩЕСТВА
К кристаллическим веществам относятся все металлы и металлические сплавы.
Кристалл состоит из множества сопряженных друг с другом элементарных кристаллических ячеек. В элементарной кристаллической ячейке содержится наименьшее число атомов.
Простейшим типом элементарной кристаллической ячейки является простая кубическая решетка. Размеры кристаллической решетки характеризуются ее параметрами. Под параметром решетки понимают расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку. Эти расстояния очень малы и их измеряют в нанометрах или ангстремах (1А = 10-10 м). Параметр кубической решетки (рис. 1.5) обозначается буквой а и находится в пределах 0,28...0,6 нм. Параметр решетки хрома равен 2,9 А , алюминия - 4,04 А. Следовательно, в кристаллическом веществе на 1 мм размещаются десятки миллионов атомов.
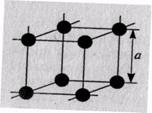
Рис. 1.4.Элементарная ячейка кубической решетки
Для описания структуры кристаллических тел пользуются понятием пространственной кристаллической решетки, которая представляет собой пространственную сетку, в узлах которой располагаются частицы, образующие твердое тело.
В узлах ковалентных (атомных) решеток находятся нейтральные атомы, которые связаны друг с другом ковалентной связью.
В узлах ионных решеток расположены чередуясь положительные и отрицательные ионы, которые связаны друг с другом ионной связью.
В узлах металлических решеток расположены положительные ионы, в промежутках между которыми находятся свободные электроны. Они образуют решетку с помощью металлических связей.
В узлах молекулярных решеток находятся молекулы. Такие решетки образуются за счет ковалентной и ионной связей.
Каждое вещество обычно образует кристаллы определенной формы. Порядок взаимного расположения атомов в кристалле может быть различным.

Рис. 1.5. Основные типы кристаллических решеток металлов:
а - кубическая объемно центрированная; б - кубическая гранецентрированная; в – гексагональная
Стремление атомов металлов к сближению и уплотнению приводит к образованию более сложных типов решеток. Наиболее распространенными типами кристаллических решеток являются:
кубическая объемно центрированная (см. рис. 1.5, а), ее имеют 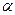 -железо, хром, вольфрам, ванадий;
-железо, хром, вольфрам, ванадий;
кубическая гранецентрированная (см. рис. 1.5, б), ее имеют  -железо, медь, алюминий;
-железо, медь, алюминий;
гексагональная (см. рис. 1.5, в), ее имеют бериллий, кадмий, магний и другие металлы.
Наиболее плотно и компактно размещены атомы гексагональной и кубической гранецентрированной решеток.
Упорядоченное расположение атомов в кристаллах приводит к различному расположению и плотности атомов в разных направлениях. Этим обусловлено различие свойств металлов в разных направлениях.
Изменение свойств кристаллов (металлов) в зависимости от направления называют анизотропией.
Степень анизотропности свойств металлов может быть значительной. Например, предел прочности на растяжение у меди изменяется от 120 до 360 МПа, а относительное удлинение при растяжении (  ) - до 55%.
) - до 55%.
Однако промышленные сплавы обычно состоят из большого числа кристаллов, кристаллические решетки которых по-разному ориентированы в пространстве, поэтому свойства сплавов не зависят от направления.
Все кристаллические вещества при нагревании сохраняют твердое состояние до определенной температуры. Атомы, находящиеся в узлах кристаллической решетки, совершают непрерывные колебательные движения. Чем выше температура вещества, тем больше амплитуда этих колебаний. При достижении определенной температуры амплитуда колебаний атомов настолько увеличивается, что происходит разрушение кристаллической решетки. Атомы переходят в хаотическое состояние, а вещество превращается из твердого в жидкое. Температура, при которой происходит фазовое превращение твердого вещества в жидкое, называется температурой плавления Тпл.
Обратный переход кристаллических веществ из жидкого состояния в твердое называется кристаллизацией. Температура, при которой происходит фазовое превращение жидких веществ в кристаллические, называется температурой кристаллизации Тк.
Дефекты кристалических решеток
Строение металлов, когда атомы образуют геометрически правильную кристаллическую структуру, может быть только в идеальном случае. В реальных условиях кристаллы имеют большое число дефектов, наличие которых оказывает существенное влияние на свойства металлов и сплавов.
Основными дефектами кристаллических решеток являются точечные, линейные, поверхностные и объемные (трехмерные) несовершенства.
1) Точечные
Точечные несовершенства появляются в результате образования вакансий (атомных дырок) или внедрения атомов в междуузлие (рис. 1.6).
Рис1.6. Точечные несовершенства:
1 – вакансия; 2 – дислоцированный атом; 3 – примесный атом
Атомы металлов находятся в колебательном движении относительно положения равновесия. При нагревании амплитуда колебаний атомов возрастает. Большинство атомов в данной кристаллической решетке обладает одинаковой средней энергией, поэтому амплитуда их колебаний при данной температуре одинакова, но отдельные атомы имеют энергию, значительно превышающую среднюю, и амплитуда колебаний их также больше среднего значения. Такие атомы могут перемещаться из одного места в другое и выходить из узла в междуузлие. Атомы, вышедшие из узла решетки, называются дислоцированными, а места, где находились атомы, остаются в решетке незаполненными и называются вакансиями.
Причинами точечных несовершенств являются условия кристаллизации, наличие примесей в металлах и сплавах, неравномерное распределение энергии между атомами кристаллической решетки.
Точечные дефекты влияют на диффузионные процессы. Например, при изготовлении полупроводниковых интегральных схем нагревание до температуры плавления приводит к увеличению вакансий на 2%.
2) Линейные
Линейные несовершенства представляют собой изменения структуры, протяженность которых в одном измерении гораздо больше, чем в двух других. Такие несовершенства называют дислокациями. Появление дислокаций вызвано воздействиями на металл напряжений разного происхождения. При воздействии сосредоточенной нагрузки на некоторый участок происходит перераспределение напряжений в образце. Этот процесс сопровождается медленным сдвигом атомов. Граница между сдвинутыми участками и сохранившейся без изменения областью является дислокацией (рис. 1.7).
Дислокации бывают краевыми, винтовыми и смешанными.
Рис. 1.7. Линейные дислокации
3) Поверхностные
Поверхностные несовершенства характеризуются значительными изменениями в двух измерениях. Примером поверхностного несовершенства является граница между кристаллами в реальных сплавах.
Кристалл состоит из блоков, которые по-разному ориентируются в пределах этого кристалла, образуя мозаичную структуру. На границах повернутых друг относительно друга блоков возникают напряжения, приводящие к искажению кристаллической решетки (рис. 1.8).

Рис. 1.8. Поверхностные несовершенста (мозаичная структура кристалла)
4) Объемные
Объемные несовершенства кристалла имеют существенные размеры во всех трех измерениях. К объемным дефектам относятся пустоты, включения отдельных кристаллических зерен или кристаллической модификации.
По структуре кристаллические материалы бывают монокристаллическими и поликристаллическими.
Монокристаллические материалы - это однородные анизотропные тела, у которых атомы расположены по всему объему в правильном порядке. При этом сами атомы состоят из периодически повторяющихся одинаковых кристаллических ячеек.
Поликристаллические материалы состоят из большого числа сросшихся между собой мелких кристаллических зерен (кристаллитов), которые хаотически ориентированы в разных направлениях. За счет усреднения свойств отдельных кристаллов свойства тела в целом не зависят от направления, и поликристаллические материалы обычно изотропны. Однако с помощью специальной обработки (холодная прокатка с последующим отжигом, намагничивание, поляризация и т.д.) материал становится анизотропным. Материалы с искусственно созданной анизотропией называют текстурами.
К поликристаллическим материалам относятся металлы и многие керамические материалы.
АМОРФНЫЕ ВЕЩЕСТВА
В аморфных веществах атомы и молекулы расположены беспорядочно. В отличие от кристаллических аморфные вещества не имеют строго определенной температуры перехода из твердого состояния в жидкое. Этот переход осуществляется в некотором диапазоне температур. При понижении температуры у аморфных материалов, находящихся в жидком состоянии, происходит быстрое повышение вязкости, которое затрудняет перемещение молекул, необходимое для формирования и роста кристаллов.
Свойства аморфных тел не зависят от выбранного направления, так как аморфные тела изотропны. Например, при охлаждении расплавленного кристалла кварца образуется так называемый плавленный кварц, свойства которого одинаковы по всем направлениям и при этом не отличаются от свойств кристаллического кварца.
Аморфные вещества делятся на две группы:
простые аморфные, к которым относятся низкомолекулярные жидкости, неорганические стекла, плавленный кварц и др.;
высокополимерные соединения, к которым относятся каучуки, резины, органические стекла, смолы.
АМОРФНО-КРИСТАЛЛИЧЕСКИЕ ВЕЩЕСТВА
Некоторые вещества могут находиться в кристаллическом и аморфном состояниях. Аморфное состояние вещества менее устойчиво, чем кристаллическое, поэтому возможен самопроизвольный переход вещества из аморфного состояния в кристаллическое. Примером такого превращения служит расстекловывание, в процессе которого происходит самопроизвольная кристаллизация стекла при повышенных температурах или давлении. В связи с образованием мелких кристалов стекло меняет свои оптические свойства и превращается в аморфно-кристаллический материал, называемый ситаллом.
Аморфно-кристаллическое состояние свойственно оксиду кремния, который встречается в природе в виде кристаллов кварца, а также в аморфном состоянии в виде минерала опал. В определенном интервале температур в термодинамически устойчивом состоянии, которое характерно для аморфно-кристаллических веществ, находятся жидкие кристаллы.
КЛАССИФИКАЦИЯ ЭЛЕКТРОМАТЕРИАЛОВ
1) По назначению
По назначению материалы, используемые в различных областях электроники, условно подразделяют на конструкционные и электротехнические.
Конструкционные материалы применяют для изготовления несущих конструкций, а также вспомогательных деталей и элементов радиоприборов, работающих в условиях воздействия механических нагрузок.
Электротехнические материалы находят применение в электротехнике, электронике и радиоэлектронике. Применение этих материалов в обусловлено прежде всего их электрическими и магнитными свойствами.
2) по электрическим свойствам
В процессе изготовления и в различных условиях эксплуатации на электротехнические материалы воздействуют электрическое и магнитное поля в отдельности и совместно. По поведению в электрическом поле эти материалы подразделяют на
- проводниковые,
- полупроводниковые
- диэлектрические.
Классификация электроматериалов по электрическим свойствам основана на представлениях зонной теории электропроводности твердых тел.
Сущность зонной теории электропроводности твердых тел
В изолированном атоме электроны вращаются вокруг ядра на определенных орбитах. Согласно принципу Паули на каждой орбите может находиться не более двух электронов. Каждой орбите соответствует строго определенное значение энергии, которой может обладать электрон, т. е. каждая орбита представляет собой определенный энергетический уровень. Под воздействием притяжения положительно заряженного атомного ядра электроны стремятся занять ближайшие к ядру уровни с минимальным значением энергии. Поэтому нижние энергетические уровни оказываются заполненными электронами, а верхние уровни - свободными.
Электрон может скачкообразно перейти с нижнего энергетического уровня W1 на другой свободный уровень W2 (рис. 2.1). Для этого электрону необходимо сообщить дополнительную энергию 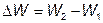 . Если свободных уровней в атоме нет, то электрон не может изменить свою энергию, поэтому не участвует в создании электропроводности.
. Если свободных уровней в атоме нет, то электрон не может изменить свою энергию, поэтому не участвует в создании электропроводности.
В кристаллической решетке, состоящей из нескольких атомов, отдельные энергетические уровни расщепляются на подуровни, которые образуют энергетические зоны (см. рис. 2.1). При этом расщепляются свободные и заполненные энергетические уровни.
Зона, заполненная электронами, называется валентной. Верхний уровень валентной зоны (потолок) обозначается Wv.
Свободная зона называется зоной проводимости. Нижний уровень зоны проводимости (дно) обозначается Wc.
Промежуток между валентной зоной и зоной проводимости называют запретной зоной  . Значение запретной зоны существенно влияет на свойства материалов.
. Значение запретной зоны существенно влияет на свойства материалов.
Если  равна или близка к нулю, то электроны могут перейти на свободные уровни благодаря собственной тепловой энергии и увеличить проводимость вещества. Вещества с такой структурой энергетических зон относят к проводникам. Типичными проводниками являются металлы. Проводниковые материалы служат для проведения электрического тока. Обычно к проводникам относят вещества с удельным электрическим сопротивлением
равна или близка к нулю, то электроны могут перейти на свободные уровни благодаря собственной тепловой энергии и увеличить проводимость вещества. Вещества с такой структурой энергетических зон относят к проводникам. Типичными проводниками являются металлы. Проводниковые материалы служат для проведения электрического тока. Обычно к проводникам относят вещества с удельным электрическим сопротивлением  менее 10-5 Ом-м.
менее 10-5 Ом-м.
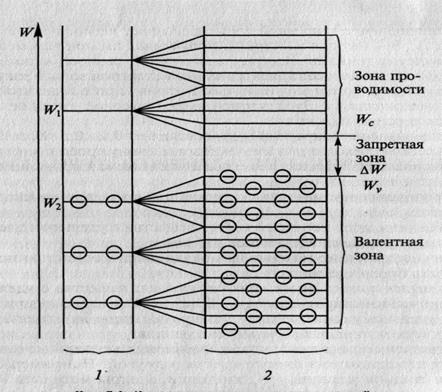
Рис. 2.1. Диаграмма энергетических уровней изолированного атома (1) и твердого тела (2)
Если значение запретной зоны превышает несколько электрон-вольт (1 эВ - энергия электрона, полученная им при перемещении между двумя точками электрического поля с разностью потенциалов 1В), то для перехода электронов из валентной зоны в зону проводимости требуется значительная энергия. Такие вещества относят к диэлектрикам. Диэлектрические материалы обладают способностью препятствовать прохождению тока.
Диэлектрики имеют высокое удельное электрическое сопротивление. К диэлектрическим материалам относят вещества с удельным электрическим сопротивлением  более 107 Омм. Благодаря высокому удельному электрическому сопротивлению их используют в качестве электроизоляционных материалов.
более 107 Омм. Благодаря высокому удельному электрическому сопротивлению их используют в качестве электроизоляционных материалов.
Если значение запретной зоны составляет 0,1...0,3 эВ, то электроны легко переходят из валентной зоны в зону проводимости благодаря внешней энергии. Вещества с управляемой проводимостью относят к полупроводникам. Полупроводниковые материалы обладают проводимостью, с помощью которой можно управлять напряжением, температурой, освещенностью и т.д. Удельное электрическое сопротивление полупроводников составляет 10-6...109 Ом-м.
В зависимости от структуры и внешних условий материалы могут переходить из одного класса в другой. Например, твердые и жидкие металлы - проводники, а пары металлов - диэлектрики; типичные при нормальных условиях полупроводники германий и кремний при воздействии высоких гидростатических давлений становятся проводниками; углерод в модификации алмаза - диэлектрик, а в модификации графита - проводник.
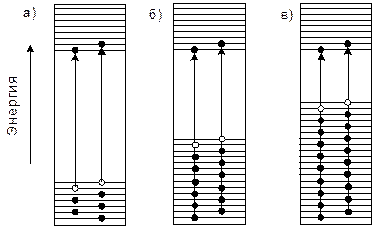
Рис.2.2. Диаграмма энергетических уровней для проводников, полупроводников и диэлектриков
Рис.2.3. Сопротивления электротехнических материалов
Основным свойством вещества по отношению к электрическому полю является электропроводность, характеризующая способность материала проводить электрический ток под воздействием постоянного электрического поля, т. е. поля, напряжение которого не меняется во времени.
Электропроводность характеризуется удельной электрической проводимостью  и удельным электрическим сопротивлением
и удельным электрическим сопротивлением  :
:

где J - плотность тока;  - удельная электрическая проводимость, См/м; Е -напряженность электрического поля, В/м;
- удельная электрическая проводимость, См/м; Е -напряженность электрического поля, В/м;  - удельное электрическое сопротивление, Ом м.
- удельное электрическое сопротивление, Ом м.
Значения удельной электрической проводимости  и удельного электрического сопротивления
и удельного электрического сопротивления  у разных материалов существенно различаются. В сверхпроводящем состоянии удельное электрическое сопротивление материалов равно нулю, а у разреженных газов стремится к бесконечности.
у разных материалов существенно различаются. В сверхпроводящем состоянии удельное электрическое сопротивление материалов равно нулю, а у разреженных газов стремится к бесконечности.
3) по магнитным свойствам
Все материалы, находясь в магнитном поле, обладают определенными магнитными свойствами, которые обусловлены внутренними формами движения электрических зарядов.
По характеру взаимодействия с внешним магнитным полем все электрооматериалы подразделяются на немагнитные и магнитные.
Немагнитные материалы не взаимодействуют с магнитным полем, т.е. не приобретают магнитных свойств при воздействии на них магнитного поля (диамагнтики).
Магнитные материалы обладают способностью намагничиваться.
В изолированном атоме электроны вращаются вокруг ядра с определенным орбитальным моментом. Одновременно электроны вращаются вокруг своих осей со спиновыми магнитными моментами. Орбитальные и спиновые магнитные моменты, суммируясь, образуют магнитный момент атома. Магнитные свойства атома определяются в основном магнитными свойствами электрона, так как магнитный момент электронной оболочки атома приблизительно в 1000 раз больше магнитного момента атомного ядра.
Так как электроны с правым и левым вращениями имеют различное направление магнитных моментов, то суммарный магнитный момент атома может быть равен нулю или отличен от него.
Материалы с разной электронной структурой атомов обладают разными магнитными свойствами.
По силе взаимодействия с магнитным полем все материалы подразделяют на
1) слабомагнитные (диамагнетики, парамагнетики)
2) сильномагнитные (ферромагнетики, антиферромагнетики, ферримагнетики).
Сила взаимодействия вещества с магнитным полем оценивается безразмерной величиной - магнитной восприимчивостью
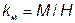
где М - намагниченность вещества под действием магнитного поля, А×м-1; Н-напряженность магнитного поля, А×м-1.
Слабомагнитные материалы незначительно меняют свою намагниченность под действием внешнего намагничивающего поля и характеризуются магнитной восприимчивостью kM<< 1.
К слабомагнитным материалам относятся диамагнетики и парамагнетики.
Диамагнетики представляют собой материалы, состоящие из атомов, у которых оболочки полностью заполнены электронами. Поэтому результирующий магнитный момент атома равен нулю. Диамагнетизм присущ всем материалам и выражается тем сильнее, чем больше электронов в атомах и чем дальше они расположены от ядра. Их магнитные свойства проявляются благодаря повороту электронных орбит под действием внешнего намагничивающего поля. Благодаря этому появляется результирующий магнитный момент, направленный встречно внешнему полю и ослабляющий внешнее поле внутри диамагнетика.
Магнитная восприимчивость диамагнетиков kM= -10-5 в большинстве случаев не зависит от температуры и напряженности намагничивающего поля.
Внешне диамагнетизм проявляется в том, что диамагнетик “выталкивается” из неоднородного магнитного поля.
К диамагнетикам относят большинство органических соединений и ряд металлов: медь, серебро, золото, свинец и др.
Парамагнетики характеризуются тем, что магнитные моменты отдельных атомов парамагнетиков ориентированы хаотично и в объеме твердого тела скомпенсированы. При помещении этих материалов в магнитное поле происходит ориентация незначительного числа магнитных моментов атомов и.усиление внешнего поля внутри парамагнетика. Это является следствием совпадения направления намагниченности парамагнетиков с направлением внешнего поля. После снятия внешнего магнитного поля парамагнетики сохраняют небольшую намагниченность.
Магнитная восприимчивость kM= 10-2...10-5. У большинства парамагнетиков kM значительно зависит от температуры, для некоторых парамагнетиков (щелочных металлов) kM от температуры не зависит, а для некоторых имеет место аномальная зависимость. От напряженности поля при нормальной температуре парамагнетическая восприимчивость зависит слабо, но при температурах, близких к температуре Кюри, парамагнетики можно перевести в состояние магнитного насыщения. Внешне парамагнетизм проявляется в том, что парамагнетик “втягивается” в неоднородное магнитное поле.
К парамагнетикам относят алюминий, платину и др.
Сильномагнитные материалы обладают способностью к значительному изменению намагниченности под действием внешнего поля и характеризуются магнитной восприимчивостью kM>>1.
К сильномагнитным материалам относятся ферромагнетики, антиферромагнетики и ферримагнетики.
Ферромагнетики характеризуются следующими свойствами:
- способностью сильно намагничиваться даже в слабых магнитных полях (kM = 103... 105);
- способностью переходить из ферромагнитного в парамагнитное состояние при температуре, превышающей температуру Кюри Тк, т.е. способность терять магнитную восприимчивость на 3...4 порядка.
Магнитная восприимчивость kM имеет сложную нелинейную зависимость от температуры и напряженности поля.
Ферромагнетики относятся к переходным элементам, у которых нарушен нормальный порядок заполнения электронных оболочек, в результате чего атомы имеют внутренние незаполненные оболочки. Это приводит к тому, что атомы этих элементов обладают нескомпенсированным магнитным моментом. В материалах, у которых суммарный магнитный момент атома отличен от нуля, образуются домены, т.е. области, самопроизвольно намагниченные до насыщения в отсутствие внешнего магнитного поля. В зависимости от кристаллической структуры вещества домены имеют различную форму. Линейные размеры домена составляют от тысячных до десятых долей миллиметра. Отдельные домены отделены друг от друга пограничным слоем толщиной 10-2...10-8 м. В зависимости от электронного взаимодействия нескомпенсированные спины соседних атомов устанавливаются параллельно или антипараллельно. Материалы, у которых нескомпенсированные спины соседних атомов устанавливаются параллельно, являются ферромагнетиками.
Процесс намагничивания ферромагнетика начинается с роста наиболее благоприятно ориентированных доменов. Такими являются домены, у которых направления магнитных моментов близки к направлению напряженности намагничивающего поля. Число этих доменов увеличивается из-за смещения границ менее благоприятно ориентированных доменов. После окончания роста доменов в объеме кристалла намагничивание материала продолжается из-за поворота магнитных моментов доменов. При совпадении направления векторов магнитных моментов доменов с направлением напряженности магнитного поля наступает магнитное насыщение (рис. 2.4). При дальнейшем повышении напряженности внешнего электромагнитного поля намагниченность материала увеличивается незначительно. При снятии внешнего поля векторы доменов поворачиваются в обратном направлении и материал размагничивается, но не полностью.

Рис. 2.2. Схемы ориентирования вектора намагниченности в доменах ферромагнетика:
а - при отсутствии внешнего поля; б - в слабом поле с напряженностью H1; в - в сильном поле с напряженностью H2; г - при насыщении (H3 = HS) и д - кривая намагничивания
При намагничивании ферромагнетиков наблюдаются явления анизотропии и магнитострикции.
Суть магнитной анизотропии состоит в том, что намагничиваемость кристалла по разным его направлениям неодинакова. В решетке кристалла ферромагнетика существуют направления легкого и трудного намагничивания. Железо и его сплавы кристаллизуются в кубическую структуру. Осями легкого намагничивания у них являются ребра куба, а самого трудного – пространственные диагонали (рис. 2.3, а). У никеля, имеющего также кубическую структуру, распределение осей намагничивания противоположное (рис. 2.3, б). У кобальта, имеющего гексагональную структуру, направление легкого намагничивания проходит вдоль шестиугольной грани, а трудного - вдоль ребра боковых граней (рис. 2.3, в).
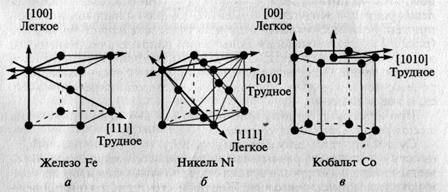
Рис. 2.3. Диаграммы направления легкого и трудного намагничивания в монокристаллах железа (а), никеля (б) и кобальта (в)
В ненамагниченном образце направления магнитных моментов доменов совпадают с осями легкого намагничивания кристалла и располагаются равновероятно. При попадании образца в электромагнитное поле самым энергетически выгодным направлением является ось легкого намагничивания, составляющая с направлением внешнего поля наименьший угол.
Намагничивание и размагничивание ферромагнетика сопровождается изменением линейных размеров и формы кристалла. Это явление называется магнитострикцией. Оно характерно для всех магнитных материалов.
Магнитострикция материала оценивается константой магнитострикции (магнитострикционная деформация насыщения)
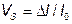
где 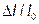 - относительное изменение линейных размеров образца, м;
- относительное изменение линейных размеров образца, м; 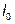 - первоначальная длина образца, м.
- первоначальная длина образца, м.
Константа магнитострикции 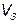 может принимать положительное и отрицательное значения. Ее значение и знак зависят от свойств материала и напряженности намагничивающего поля.
может принимать положительное и отрицательное значения. Ее значение и знак зависят от свойств материала и напряженности намагничивающего поля.
К ферромагнетикам относят железо, никель, кобальт и их сплавы, гадолиний, сплавы хрома и марганца и др.
Антиферромагнетики представляют собой материалы, у которых магнитные моменты соседних атомов равны, но их спины располагаются антипараллельно.
Магнитная восприимчивость kM = 10-3...10-5 и отличается специфической зависимостью от температуры.
Ферримагнетики во многом подобны ферромагнетикам, но обладают следующими особенностями:
- значительно уступают ферромагнетикам по значению намагниченности насыщения (предельной намагниченности) Мs;
- в ряде случаев имеют аномальную зависимость намагниченности насыщения Ms от температуры с наличием точки компенсации.
Природа ферримагнетизма была впервые подробно изучена на ферритах - соединениях оксида железа Fe2O3 с оксидом металлов, например МеО×Fe2O3 (где Ме++ -двухвалентный металл). Магнитные свойства ферримагнетиков связаны с взаимным расположением в кристаллической решетке ионов железа и металла.
Ферримагнетики являются кристаллическими веществами с доменной структурой.
Дата добавления: 2015-12-29; просмотров: 6077;
