Приклади розв’язування задач. Приклад 1. Обчислити граничне розведення, межу виявлення, граничну концентрацію і показник чутливості
Приклад 1. Обчислити граничне розведення, межу виявлення, граничну концентрацію і показник чутливості, якщо 0,005мкг речовини калій катіона можна виявити у розчині об’ємом 0,05см3.
Дано:
mmin(К+) = 0,005 мкг
Vmin(К+(р)) = 0,05 см3
 Vгран(К+(р)) – ?
Vгран(К+(р)) – ?
Сгран(К+) – ?
Сmin1(К+) – ?
pD – ?
Розв’язування
1. Визначення граничного розведення.
Vгран(К+(p)) = [Vmin(К+(p))·106]:mmin(К+) = (0,05см3·106мкг/г):0,005мкг = =1·107см3/г
2. Визначення граничної концентрації.
Сгран(К+) = 1:Vгран(К+(p)) = 1г:1·107см3 = 1:1·107 г/см3
3. Визначення межі виявлення.
Сmin1(К+) = 1г:1·107см3 = 1·10–7 г/см3
4. Визначення показника чутливості.
pD = –lgCmin1(К+) = –lg1·10–7 = 7.
Приклад 2. Визначити масу речовини BaCl2·2H2O, що викристалізується при охолодженні насиченого при 100°С розчину барій хлориду масою 794г до 10°С, якщо коефіцієнти розчинності його дорівнюють 0,588 при 100°С і 0,357 при 10°С.
Дано:
m(BaCl2(p)) = 794г М(BaCl2 ) = 208г/моль
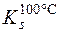 = 0,558 M(BaCl2·2H2O) = 244г/моль
= 0,558 M(BaCl2·2H2O) = 244г/моль

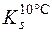 = 0,357
= 0,357
m(BaCl2·2Н2О) – ?
Розв’язування
1. Визначення маси речовини BaCl2, що міститься в насиченому при 100°С розчині.
m(BaCl2) = 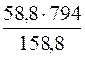 = 294г
= 294г
2. Визначення маси води у розчині, насиченому при 100°С.
m(H2O) = 794г–294г = 500г
3. Визначення маси речовини BaCl2·2H2O, що викристалізується при 10°С. Позначимо масу ВаСl2·2H2O, яка викристалізується при 10°С, за x, тобто:
m(BaCl2·2Н2О) = x г.
Тоді маса води, що міститься в x г BaCl2·2Н2О, дорівнює: m(H2O) = 36x:244 = 0,1475·х г, а в розчині залишиться (500–0,1475·х)г води.
Маса BaCl2, яка міститься в х г BaCl2·2H2O, дорівнює: m(BaCl2) = 208х:244 = 0,8525х г, а у розчині залишиться (294–0,8525)г барій хлориду.
Таким чином, є рівність:
У 100г води розчиняється 35,7г BaCl2,
у (500–0,1475х)г води – (294 – 0,8525х)г BaCl2.
Тоді (294–0,8525х) = 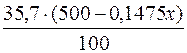 ;
;
100·(294–0,8525х) = 35,7·(500–0,1475х);
х=144,4; m(BaCl2·2H2O) = 144,4г.
Приклад 3. У воді масою 1кг розчинено калій гідроксид масою 560г. Знайти молярні частки речовин калій гідроксиду і води у розчині.
Дано:
m(H2O) = 1кг М(Н2О) = 18г/моль
 m(KOH) = 560г M(KOH) = 56г/моль
m(KOH) = 560г M(KOH) = 56г/моль
χ(KOH) – ?
χ(H2O) – ?
Розв’язування
1. Визначення кількості речовини калій гідроксиду в розчині.
n(KOH) = 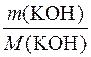 =
= 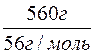 = 10моль
= 10моль
2. Визначення кількості речовини води в розчині.
n(H2O) = 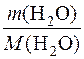 =
= 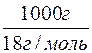 = 55,5 моль.
= 55,5 моль.
3. Визначення молярної частки речовини калій гідроксиду в розчині.
χ(KOH) = 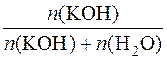 =
= 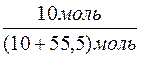 = 0,1530, або 15,30%
= 0,1530, або 15,30%
4.Визначення молярної частки води в розчині.
χ(H2O) = 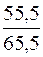 = 0,8470 або 84,70%.
= 0,8470 або 84,70%.
Приклад 4. Є розчин фосфатної кислоти з масовою часткою речовини H3PO4 38,17%. Густина розчину становить 1,24г/см3. Розрахувати молярну масу еквівалента речовини H3PO4 у розчині, якщо молярна концентрація еквівалента речовини H3PO4 у розчині 9,6580 моль/дм3.
Дано:
w(%)(H3PO4) = 38,17
ρ(H3PO4(p)) = 1,24г/см3
 c(fекв(H3PO4)H3PO4) = 9,6580 моль/дм3
c(fекв(H3PO4)H3PO4) = 9,6580 моль/дм3
M(fекв(H3PO4)H3PO4) – ?
Розв’язування
1. Визначення молярної маси еквівалента речовини H3PO4.
c(fекв(H3PO4) H3PO4) = 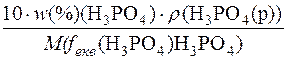
M(fекв(H3PO4) H3PO4) = 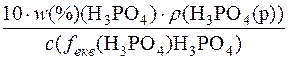 =
=
= 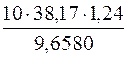 = 49 г/моль
= 49 г/моль
Отже, M(fекв(H3PO4)H3PO4) = 49г/моль; М(H3PO4) = 98г/моль
Відомо, що M(fекв(X)X) = fекв(X)·М(X), тоді M(fекв(H3PO4)H3PO4) = = fекв(H3PO4)·М(H3PO4)
fекв(H3PO4) = M(fекв(H3PO4)H3PO4)/М(H3PO4)
fекв(H3PO4) = 49г/моль: 98г/моль = ½
Отже, fекв(H3PO4) = ½. Тоді М(½H3PO4) = 49г/моль.
Приклад 5. У воді масою 60г розчинили сульфатну кислоту масою 40г. Використовуючи ці дані, виразити склад розчину і концентрацію H2SO4 всіма відомими способами.
1. Масова частка (%) розчиненої речовини в розчині.
Дано:
m(H2O) = 60г
 m(H2SO4) = 40г
m(H2SO4) = 40г
w(%)(H2SO4) – ?
w(%)(H2SO4) = m(H2SO4):[m(H2SO4)+m(H2O)]·100 =
= 40г:(40г+60г)·100 = 40,00%.
2. Мольна частка (%) розчиненої речовини в розчині.
Дано:
m(H2O) = 60г M(H2SO4) = 98,08г/моль
 m(H2SO4) = 40г M(H2O) = 18,02г/моль
m(H2SO4) = 40г M(H2O) = 18,02г/моль
χ(%)(H2SO4) – ?
χ(%)(H2SO4) = n(H2SO4):[n(H2SO4)+n(H2O)·100 =
= (40г:98,08г/моль):[40г:98,08г/моль+60г:18,02г/моль]·100 =
= 0,408моль:(0,408моль+3,330моль)·100 = 10,91%.
3. Моляльність розчину (відношення числа молів розчиненої речовини, що припадає на 1кг розчинника).
Дано:
m(H2O) = 60г
 m(H2SO4) = 40г
m(H2SO4) = 40г
b(H2SO4/H2O) – ?
b(H2SO4/H2O) = n(H2SO4):m(H2O) = [m(H2SO4):M(H2SO4)]:m(H2O) =
= (40г:98,08г/моль):0,06кг = 6,797моль/кг.
4. Сольватне число розчиненої речовини в розчині.
Дано:
m(H2O) = 60г
m(H2SO4) = 40г
 h(H2SO4) – ?
h(H2SO4) – ?
h(H2SO4)=n(H2O):n(H2SO4)=
= (1000г:18,02г/моль):(40г/60г·1000г:98,08г/моль)=
= 55,50моль:6,797моль = 8,16.
5. Молярна концентрація розчиненої речовини в розчині.
| Дано: m(H2O) = 60г m(H2SO4) = 40г w(%)(H2SO4) = 40,00 | З довідника: густина розчину ρ сульфатної кислоти з масовою часткою речовини 40% становить 1,303г/см3 |
c(H2SO4) – ?
c(H2SO4) = 10·w(%)(H2SO4)·ρ(H2SO4(p))/M(H2SO4) =
= 10·40,00%·1,303г/см3/98,08г/моль = 5,3140моль/дм3.
6. Молярна концентрація еквівалента речовини H2SO4 у розчині за умови, що цей розчин буде використано для реакції сульфатної кислоти, у якій фактор еквівалентності дорівнює ½.
Дано: w(%)(H2SO4) = 40,00
m(H2O) = 60г ρ(H2SO4(p)) = 1,303г/см3
 m(H2SO4) = 40г M(H2SO4) = 98,08г/моль
m(H2SO4) = 40г M(H2SO4) = 98,08г/моль
с(½H2SO4) – ? M(½H2SO4) = 49,04г/моль
с(½H2SO4) = 10·w(%)(H2SO4)·ρ(H2SO4(p))/M(½H2SO4) =
= 10·40,00%·1,303г/см3/49,04г/моль = 10,6281моль/дм3.
Приклад 6. До 20см3 розчину аргентум нітрату, с(AgNO3)=0,40моль/дм3, додали 40см3 розчину калій ціаніду, с(KCN)=0,50моль/дм3. Обчислити рівноважну молярну концентрацію речовини аргентум-іонів у суміші, якщо константа нестійкості аніона [Ag(CN)2]− становить 1,0·10–21.
Дано:
V(AgNO3) = 20см3
с(AgNO3) = 0,40моль/дм3
V(KCN) = 40см3
с(KCN) = 0,50моль/дм3
 Kн[Ag(CN)2]– = 1,0·10–21
Kн[Ag(CN)2]– = 1,0·10–21
[Ag+] – ?
Розв’язування
Визначаються молярні концентрації кожної речовини після змішування розчинів.
Загальний об’єм суміші після змішування становить 60см3.
с(AgNO3) = (0,40·20)/60 = 0,13моль/дм3 ; с(Ag+) = 0,13моль/дм3.
с(KCN) = (0,50·40)/60 = 0,33моль/дм3 ; с(CN–) = 0,33моль/дм3.
Молярна концентрація речовини калій ціаніду по відношенню до молярної концентрації аргентум нітрату є в надлишку, тому у розчині може відбуватися процес комплексоутворення:
Ag+ + 2CN– D [Ag(CN)2]–.
Цей процес зворотний, який кількісно можна охарактеризувати константою нестійкості комплексного йона.
Визначаємо рівноважну концентрацію Ag+ у суміші.
[Ag(CN)2]– D Ag+ + 2CN–
| 1моль | 1моль | 2моль | |
| срівн. | х моль | 2х моль | |
Kн[Ag(CN)2]– = 
[Ag+] = х моль;
[CN–]=с(CN–)–2(с(Ag+)–х);
[CN–] = 0,33–2·(0,13–х) = 0,33–2–0,13 = 0,07моль/дм3;
[Ag(CN)2]– = с(Ag+)–х = (0,13–х)моль/дм3.
Оскільки х – мала величина у порівнянні з молярною концентрацією Ag+, то значенням х можна знехтувати.
1,0·10–21 = 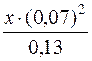 ; х= 2,65·10–20.
; х= 2,65·10–20.
Рівноважна концентрація аргентум-іонів у розчині
[Ag+]=2,65·10–20моль/дм3.
Приклад 7. Молярна концентрація речовини Н+-іонів у розчині ацетатної кислоти (с(СН3ООН)=0,1моль/дм3) становить 1,3·10–3 моль/дм3.Обчислити константу і ступінь дисоціації кислоти.
Дано:
с(СН3СООН) = 0,1моль/дм3
 [H+] = 1,3·10–3моль/дм3
[H+] = 1,3·10–3моль/дм3
Kд(CH3COOH) – ?
α – ?
Розв’язування
CH3COOH D H+ + CH3COO–
У стані рівноваги [H+] = [CH3COO–]= с·α; a[CH3COOH] = с–с·α
Kд(CH3COOH) = 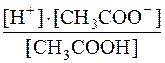 =
= 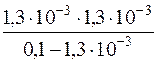 =1,71·10–5
=1,71·10–5
Kд(CH3COOH) = α2·с(CH3COOH); α= 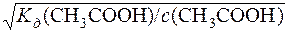 =
= 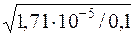 = 0,0171 (1,71%).
= 0,0171 (1,71%).
Приклад 8. Розрахувати активність натрій-іонів і сульфат-іонів у розчині, в 1дм3 якого міститься 0,005 натрій сульфату і 0,02моль ацетатної кислоти.
Дано:
с(Na2SO4) = 0,005моль/дм3
с(СH3COOH) = 0,02моль/дм3
 а(Na+) – ?
а(Na+) – ?
a(  ) – ?
) – ?
Розв’язування
Визначаються молярні концентрації Na+ і  у розчині.
у розчині.
Na2SO4 " 2Na+ + 
| 1моль | 2моль | 1моль | |
| срівн. | (0,005·2) моль | 0,005 моль | |
[Na+] = 0,01моль/дм3; [  ] = 0,005моль/дм3.
] = 0,005моль/дм3.
Дисоціацією молекул ацетатної кислоти нехтують, оскільки ацетатна кислота – слабкий електроліт і участь її у створенні йонної сили не суттєва.
Розраховують йонну силу розчину.
μ = 3с(Na2SO4) = 3·0,005 = 0,015моль/дм3.
Коефіцієнт активності йонів Na+ за цієї йонної сили f(Na+)=0,89, a йонів  – f(
– f(  ) = 0,63 (з довідника).
) = 0,63 (з довідника).
Далі розраховують активності йонів Na+ і  у розчині.
у розчині.
а(Na+) = [Na+]·f(Na+) = 0,01· 0,89 = 8,9·10–3моль/дм3;
а(  ) = [
) = [  ]·f(
]·f(  ) = 0,005·0,63 = 3,15·10–3моль/дм3.
) = 0,005·0,63 = 3,15·10–3моль/дм3.
Приклад 9. Розрахувати ступінь дисоціації і pH у розчині ацетатної кислоти (с(СН3СООН) = 0,2моль/дм3) з урахуванням коефіцієнтів активності.
Дано:
с(СН3СООН) = 0,2моль/дм3 Kд(СH3COOH) = 1,74·10–5. (μ=0)
 α – ?; рН - ?
α – ?; рН - ?
Розв’язування
Визначають наближену молярну концентрацію йонів Н+ у розчині.
СН3СООН D Н+ + СН3СОО–
| 1моль | 1моль | 1моль | |
| срівн. | (с–сα)моль | (сα)моль | (сα)моль |
[H+] = [СН3СОО–]
Оскільки ступінь дисоціації – мала величина, то допускають, що рівноважна концентрація СН3СООН дорівнює початковій молярній концентрації ацетатної кислоти, тобто [СН3СООH] = с(СН3СООН).
[H+] = 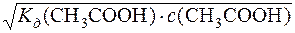 =
= 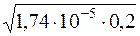 = 1,87·10–3
= 1,87·10–3
[H+] = 1,87·10–3моль/дм3.
Далі визначають йонну силу розчину.
Оцтова кислота – бінарний електроліт, тому
[H+] = [СН3СОО–] = 1,87·10–3 моль/дм3 і μ=1,87·10–3.
За рівнянням Девіса визначають точне значення константи дисоціації СН3СООН.
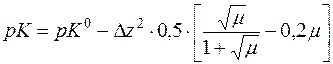
Δz2 = Σnz2 продуктів реакції – Σmz2 вихідних речовин = 1+1–0=2
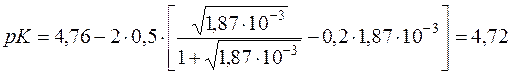
Kд(СH3COOH) = 1,92·10–5.
Визначають молярну концентрацію йонів H+ з урахуванням активності.
[H+]а= 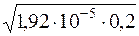 = 1,96·10–3.
= 1,96·10–3.
[H+]а = 1,96·10–3 моль/дм3.
Далі визначають раН розчину і ступінь дисоціації CH3COOH.
раH = –lg[H+]a = –lg1,96·10–3 = 2,71
α =  =
= 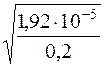 = 9,8·10–3 або 0,98%
= 9,8·10–3 або 0,98%
раН = 2,71
α = 0,98%
Приклад 10. Як зміниться pH і ступінь дисоціації амоній гідроксиду у розчині з с(NH3·H2O)=1,0моль/дм3 після додавання до розчину речовини амоній хлориду в такій кількості, щоб молярна концентрація речовини амоній хлориду в розчині стала 0,2моль/дм3?
Дано:
с(NH3·H2O) = 1,0моль/дм3 Kд(NH3·H2O) = 1,76·10–5
 с(NH4Cl) = 0,2моль/дм3
с(NH4Cl) = 0,2моль/дм3
pH1 – ? α1 – ?
pH2 – ? α2 – ?
Розв’язування
Визначення молярної концентрації гідроксид-іонів у розчині NH3·H2O до додавання солі:
[OH–] = 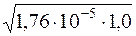 = 4,20·10–3моль/дм3.
= 4,20·10–3моль/дм3.
Визначення ступеня дисоціації амоній-гідроксиду:
α = (4,20·10–3/1,0)·100 = 0,42%
Визначення pOH розчину:
pOH = –lg4,20·10–3 = 2,38
Визначення pH розчину:
pH = 14–pOH = 14–2,38 = 11,62
Визначення молярної концентрації гідроксид-іонів у розчині після додавання солі NH4Cl:
[OH–] = 1,76·10–5·1,0/0,2 = 8,8·10–5моль/дм3
Визначення ступеня дисоціації амоній гідроксиду після додавання солі NH4Cl:
α = (8,8·10–5/1,0)·100 = 0,009%
Визначення pOH розчину після додавання солі NH4Cl:
pOH = –lg8,8·10–5 = 4,06
Визначення pH розчину після додавання солі NH4Cl:
pH = 14–pOH = 14–4,06 = 9,94
Після додавання до 1,0М розчину амоній гідроксиду амоній хлориду pH зміниться з 11,62 до 9,94, а ступінь дисоціації зменшиться з 0,42% до 0,009%.
Приклад 11. Розрахувати, як зміниться pH, якщо до 400см3 буферного розчину з молярними концентраціями амоній гідроксиду 0,2моль/дм3 і амоній хлориду 0,3моль/дм3 додати 100см3 розчину NaOH з молярною концентрацією натрій гідроксиду 0,05моль/дм3.
Дано:
V(NH3·H2O+NH4Cl) = 400cм3 Kд(NH3·H2O) = 1,76·10–5
с(NH3·H2O) = 0,2моль/дм3
с(NH4Cl) = 0,3моль/дм3
V(NaOH) = 100см3
с(NaOH) = 0,05моль/дм3
 ΔpH – ?
ΔpH – ?
Розв’язування
Допускають, що [NH3·H2O] ≈ с(NH3·H2O) = 0,2моль/дм3; [NH4Cl] ≈ с(NH4Cl) = 0,3моль/дм3.
Визначають молярну концентрацію гідроксид-іонів у буферному розчині:
[OH–] = Kд(NH3·H2O)· 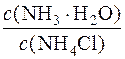 = 1,76·10–5·
= 1,76·10–5· 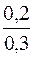 = 1,7·10–5моль/дм3
= 1,7·10–5моль/дм3
Визначають pOH і pH буферної системи:
pOH = –lg[OH–] = 1,7·10–5 = 4,93; pH = 14–pOH = 14–4,93 = 9,07.
Додавання розчину натрій гідроксиду викликає перетворення частини амоній-іонів в амоніак.
Визначають молярні концентрації амоніаку і амоній хлориду у розчині після додавання натрій гідроксиду:
с(NH3·H2O) =  = 0,17моль/дм3
= 0,17моль/дм3
с(NH4Cl) = 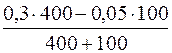 = 0,23моль/дм3
= 0,23моль/дм3
Визначають молярну концентрацію гідроксид-іонів у буферному розчині після додавання розчину натрій гідроксиду:
[OH–] = Kд(NH3·H2O)· 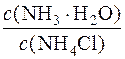 = 1,76·10–5·
= 1,76·10–5· 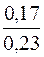 = 1,3·10–5моль/дм3
= 1,3·10–5моль/дм3
Визначають pOH і pH буферної системи після додавання розчину лугу:
pOH = –lg[OH–] = –lg1,3·10–5 = 4,87;
pH = 14–pOH = 14–4,87 = 9,13.
При додаванні лугу ∆pH = 9,13–9,07 = 0,06.
Тобто, при додаванні до буферних систем невеликих кількостей сильних основ або сильних кислот pH буферної системи змінюється в дуже незначній мірі.
Приклад 12. Обчислити, у скільки разів розчинність (моль/дм3) барій сульфату в насиченому водному розчині більша, ніж у водному розчині натрій сульфату з концентрацією Na2SO4 0,05моль/дм3
Дано:
BaSO4, с(Na2SO4)=0,05моль/дм3 ДР(BaSO4) = 1,1·10–10

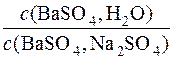 – ?
– ?
Розв’язування
У насиченому водному розчині встановлюється рівновага:
BaSO4 D Ba2+ + 
| 1моль | 1моль | ||
| срівн. | х моль | х моль | |
ДР(BaSO4) = [Ba2+]·[  ]; 1,1·10–10 = x2; x=1,05·10–5.
]; 1,1·10–10 = x2; x=1,05·10–5.
[Ba2+] = с(BaSO4). Отже, с(BaSO4, H2O) = 1,05·10–5моль/дм3.
Далі визначається молярна концентрація  -іонів у розчині натрій сульфату з с(Na2SO4)=0,05моль/дм3:
-іонів у розчині натрій сульфату з с(Na2SO4)=0,05моль/дм3:
Na2SO4 " 2Na+ + 
| 1моль | 2моль | 1моль | |
| срівн. | 0,05 моль | ||
Отже, с(  ) = 0,05моль/дм3.
) = 0,05моль/дм3.
Визначається розчинність барій сульфату у розчині натрій сульфату з с(Na2SO4)=0,05моль/дм3:
BaSO4 D Ba2+ + 
| 1моль | 1моль | ||
| срівн. | х моль | (х+0,05) моль | |
ДР(BaSO4) = [Ba2+]·[  ]; 1,1·10–10 = х·(х+0,05)
]; 1,1·10–10 = х·(х+0,05)
Оскільки величина х у загальній рівноважній молярній концентрації сульфат-іонів у порівнянні з 0,05моль мала, то нею можна знехтувати і вважати, що рівноважна молярна концентрація сульфат-іонів дорівнює 0,05моль/дм3. Тоді:
1,1·10–10 = х·0,05; х = 2,2·10–9.
Отже, с(BaSO4, Na2SO4) = 2,2·10–9моль/дм3
Далі визначається , у скільки разів молярна концентрація барій сульфату у насиченому водному розчині більша, ніж у водному розчині натрій сульфату з с(Na2SO4)=0,05 моль/дм3.
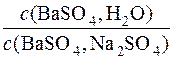 =
= 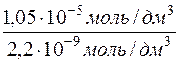 = 4772
= 4772
Відповідь: у 4772 рази розчинність барій сульфату у воді більша, ніж у водному розчині Na2SO4 з с(Na2SO4) = 0,05моль/дм3.
Приклад 13. Обчислити розчинність аргентум сульфіду у розчині хлоридної кислоти (с(НСl)=0,1моль/дм3), насиченому гідроген сульфідом (с(H2S)=0,1моль/дм3).
Дано:
Ag2S ДР(Ag2S) =6,3 · 10–50;
с(HCl) = 0,1моль/дм3 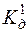 (H2S) = 1,0·10–7;
(H2S) = 1,0·10–7;
 с(H2S) = 0,1моль/дм3
с(H2S) = 0,1моль/дм3 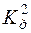 (H2S) = 2,5·10–13.
(H2S) = 2,5·10–13.
S(Ag2S) – ?
Розв’язування
Визначають молярну концентрацію Н+-іонів у розчині хлоридної кислоти:
[H+] = с(HCl) = 0,1моль/дм3.
Визначають частку речовини вільних сульфід-іонів у розчині. Процес розчинення Ag2S в HCl можна представити таким рівнянням:
Ag2S(т) D 2Ag+ + S2–
S2– + 2H+ D H2S
Або Ag2S(т) + 2Н+ D 2Ag+ + H2S
с(S2–) = [H2S] + [HS–] + [S2–]
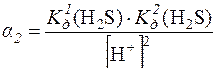 =
= 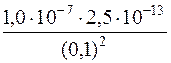 = 2,5∙10–18
= 2,5∙10–18
[S2–] = с(H2S)∙α2 = 0,1∙2,5∙10–18 = 2,5∙10–19моль/дм3
Розраховують розчинність аргентум сульфіду.
Якщо S – розчинність Ag2S, то [Ag+]=2S
Тоді (2S)2∙0,1 = ДР(Ag2S)/α2 = 6,3∙10–50/2,5∙10–19 = 2,52∙10–31
S = 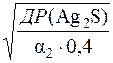 =
= 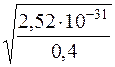 = 2,51∙10–16
= 2,51∙10–16
S(Ag2S) = 2,51∙10–16моль/дм3.
Приклад 14. Обчисліть pH у водному розчині натрій ацетату з молярною концентрацією CH3COONa 0,01моль/дм3 за температури 25oС.
Дано:
с(СН3COONa) = 0,01моль/дм3 Константа дисоціації оцтової
кислоти –
t° = 25°С Kд(CH3COOH) =1,74∙10–5
pH – ? Йонний добуток води за вказаної
температури Kw=1∙10–14
Розв’язування
Натрій ацетат гідролізується за аніоном.
CH3COO– + HOH D CH3COOH + OH–
Визначають константу гідролізу ацетат-іона:
Kг(CH3COO–) = 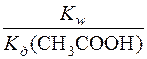 =
=  = 5,7 ∙ 10–10
= 5,7 ∙ 10–10
Визначають молярну концентрацію Н+-іонів у розчині:
[H+] = 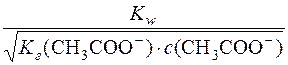 =
= 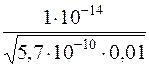 = 4,2 ∙ 10–9 моль/дм3
= 4,2 ∙ 10–9 моль/дм3
Визначають pH розчину:
pH = –lg[H+] = –lg4,2∙10–9 = 8,38.
Приклад 15. Яка маса калій ціаніду розчинена у 10см3 водного розчину його, якщо pH розчину становить 11,10?
Дано:
V(KCN) = 10см3 Kд(HCN) = 6,2∙10–10
 pH = 11,10
pH = 11,10
m(KCN) – ?
Розв’язування
Калій ціанід гідролізується за аніоном.
CN– + HOH D HCN + OH–
Визначають молярну концентрацію калій ціаніду в розчині.
pH = 7–½lg Kд(HCN)+½lgс(KCN);
½lgс(KCN) = pH–(7–½lgKд(HCN)) = pH–7+½lgKд(HCN);
lgс(KCN) = 2(pH–7+½lgKд(HCN));
lgс(KCN) = 2[11,10–7+½(–9,19)] = 2∙(–0,495) = –0,99
с(KCN) = 0,1026моль/дм3
Далі визначають масу речовини калій ціаніду, що міститься в 10 см3 цього розчину.
m(KCN) = [M(KCN)∙с(KCN)∙V(KCN)]/1000;
m(KCN) = 65,12г/моль∙0,1026моль/дм3∙0,010дм3/1000 = 0,0668г
m(KCN) = 0,0668г.
Приклад 16. Обчислити константу і ступінь дисоціації форміатної кислоти у водному розчині амоній форміату з молярною концентрацією HCOONH4 0,1моль/дм3, який має pH 6,50.
Дано:
с(HCOONH4) = 0,1моль/дм3
pH = 6,50
 Kд(HCOOH) – ?
Kд(HCOOH) – ?
α – ?
Розв’язування.
Амоній форміат гідролізується і за катіоном, і за аніоном.
HCOO– + 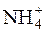 + HOH D HCOOH + NH3∙H2O
+ HOH D HCOOH + NH3∙H2O
Визначають константу дисоціації форміатної кислоти:
pH = ½pKw + ½pK(HCOOH) – ½pK(NH3∙H2O);
½pK(HCOOH) = pH–½pKw + ½pK(NH3∙H2O);
pK(HCOOH) = 2∙(pH–½pKw + ½pK(NH3∙H2O) = 2∙(6,50–7+2,38) = –3,76
Kд(HCOOH) = 1,74∙10–4
Визначають ступінь дисоціації форміатної кислоти:
 =
=  =0,0417 або 4,17%.
=0,0417 або 4,17%.
Приклад 17. Визначити напрям окисно-відновної реакції 2Fe3++Sn2+=2Fe2++Sn4+, якщо концентрації компонентів дорівнюють: с(Fe3+)=с(Sn2+)=0,001моль/дм3, с(Fe2+)=с(Sn4+)=0,1моль/дм3.
Розв’язування
За рівнянням Нернста редокс-потенциал системи визначається:
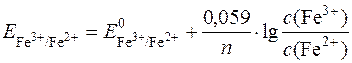 ;
;
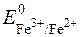 = +0,771B (табличне значення).
= +0,771B (табличне значення).
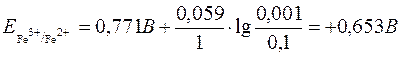 ;
;
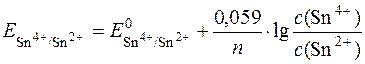 ;
;
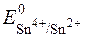 = + 0,15B (табличне значення).
= + 0,15B (табличне значення).
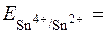 0,15B
0,15B 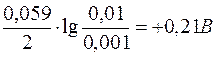 ;
;
Редокс-пара з більшим окисно-відновним потенціалом є окисником по відношенню до редокс-пари з меншим окисно-відновним потенціалом.
Отже, в даній окисно-відновній реакції окисником є Fe3+, а відновником Sn2+. Реакція буде проходити в бік утворення Sn4+ і Fe2+.
Електрорушійна сила = Еox–Ered = 0,653–0,21 = 0,443B > 0.
Приклад 18. До розчину CuSO4 з молярною концентрацією купрум сульфату 0,2моль/дм3 додали рівний об’єм розчину амоніаку з c(NH3)=2,0моль/дм3.
Обчислити молярну концентрацію Сu2+ в отриманому розчині, якщо вважати, що у розчині утворюється комплексний катіон [Cu(NH3)4]2+.
Дано:
c(CuSO4) = 0,2моль/дм3 Константа нестійкості комплексного
йона
V(CuSO4(p)) = V(NH3(p)) Kн[Cu(NH3)4]2+ = 9,33·10–13.
 c(NH3) = 2моль/дм3
c(NH3) = 2моль/дм3
[Cu2+] – ?
Розв’язування.
Визначають вихідні молярні концентрації кожної речовини після змішування розчинів.
с(CuSO4)=0,1моль/дм3; с(NH3)=1моль/дм3.
Визначають молярну концентрацію Cu2+-іона у розчині після додавання розчину амоніаку.
При додаванні розчину амоніаку концентрація Cu2+-іонів зменшується внаслідок реакції комплексоутворення:
Cu2+ + 4NH3 D [Cu(NH3)4]2+
| 1моль | 4моль |
Утворений комплексний йон [Cu(NH3)4]2+ дисоціює як слабкий електроліт:
[Cu(NH3)4]2+ D Cu2+ + 4NH3
| 1моль | 4моль | ||
| срівн. | (0,1–х) моль | х моль | (0,6–4х) моль |
Оскільки рівноважна молярна концентрація речовини [Сu(NH3)4]2+-іона дорівнює (0,1–x) моль/дм3, то молярна концентрація речовини амоніаку при утворенні цього комплексу зменшилась на 4(0,1–x)моль/дм3. Тоді рівноважна молярна концентрація амоніаку дорівнює [1–4·(0,1–x)] моль/дм3.
Kн[Cu(NH3)4]2+= 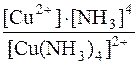 ; 9,33·10–13 =
; 9,33·10–13 = 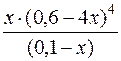
Значення x – мала величина у порівнянні з 0,1 і 0,6, тому значенням x у знаменнику і (4x)4 у чисельнику можна знехтувати. Тоді матимемо:
9,33 · 10–13 = 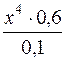 ; x = 7,2·10–14.
; x = 7,2·10–14.
Отже, [Cu2+] у розчині комплексної сполуки [Cu(NH3)4]SO4 становить 7,2·10–14моль/дм3, що свідчить про високу стійкість комплексного катіона.
Контрольні задачі
1. Мінімум відкривання натрій-іона за реакцією утворення NaZn(UO2)3(CH3COO)9·9H2O становить 12,5мкг. Гранична концентрація 1:4000г/см3. Розрахувати мінімальний об’єм гранично розведеного розчину, граничне розведення, межу виявлення та показник чутливості реакції.
Відповідь: 0,05см3 ; 4000см3/г ; 2,5·10–4г/см3; 3,6.
2. Гранична концентрація калій-іона у розчині для реакції з натрій гідрогентартратом NaHC4H4O6 становить 1:1000г/см3. Яку масу KNO3 необхідно взяти для приготування 1дм3 цього розчину?
Відповідь: 2,59г.
3. Мінімум відкривання Ag+-іона за реакцією
Mn2+ +2Ag+ + 4OH– = MnO2·H2O + 2Ag$ + H2O становить 2мкг. Гранична концентрація 1:25000г/см3. Обчислити показник чутливості реакції і мінімальний об’єм гранично розведеного розчину.
Відповідь: 4,4; 0,05см3.
4. Мінімум відкривання йона Ca2+ за реакцією:
Ca2+ + 2 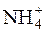 + [Fe(CN)6]4– " Ca(NH4)2[Fe(CN)6]$
+ [Fe(CN)6]4– " Ca(NH4)2[Fe(CN)6]$
становить 25мкг, межа виявлення 5·10–4г/см3. Обчислити масу речовини кальцій-іона в 1дм3, граничну концентрацію, граничне розведення, показник чутливості і мінімальний об’єм гранично розведеного розчину.
Відповідь: 0,5г/дм3; 1:2000г/см3 ; 2000см3/г; 3,5; 0,05см3
5. Мікрокристалоскопічна реакція відкриття йона Ba2+ сульфатною кислотою виходить з розчином об’ємом 0,001см3. Гранична концентрація становить 1:20000г/см3. Обчислити мінімум відкривання .
Відповідь: 0,05мкг.
6. Мінімум відкривання йона Al3+ за допомогою алізарину S становить 0,15мкг. Гранична концентрація 1:333000г/см3. Обчислити мінімальний об’єм гранично розведеного розчину і молярну концентрацію еквівалента йона Al3+ у розчині.
Відповідь: 0,05см3; 3,34·10–4моль/дм3.
7. Мінімум відкривання йона Fe3+ за реакцією:
Fe3+ + 3SCN– " [Fe(SCN)3]
становить 0,25мкг. Гранична концентрація 1:200000г/см3. Обчислити мінімальний об’єм гранично розведеного розчину та межу виявлення Fe3+-іона.
Відповідь: 0,05см3; 5·10–6г/см3.
8. Мінімум відкривання йона Fe2+ з α,α1-дипіридилом становить 0,03мкг. Гранична концентрація 1:1666000г/см3.Обчислити мінімальний об’єм гранично розведеного розчину та межу виявлення ферум(ΙΙ)-катіона.
Відповідь: 0,05см3 ; 6·10–7г/см3.
9. Мінімум відкривання йона Cu2+ за допомогою дитизону (дифенілтіокарбазону) становить 0,03мкг. Обчислити мінімальний об’єм гранично розведеного розчину і показник чутливості реакції виявлення купрум(ΙΙ)-катіона, якщо граничне розведення розчину дорівнює 1667000см3/г.
Відповідь: 0,05см3; 6,22.
10. Мінімум відкривання гідроген пероксиду за реакцією:
PbS + 4H2O2 = PbSO4$ + 4H2O
становить 0,04мкг. Обчислити граничну концентрацію, якщо мінімальний об’єм гранично розведеного розчину дорівнює 0,05см3 .
Відповідь: 1:1250000г/см3.
11. Визначити масу речовини калій хлориду, яка викристалізується при охолодженні до 20°С розчину масою 626,8г, насиченого при 100°С, якщо коефіцієнти розчинності калій хлориду становлять 0,567 при 100°С і 0,34 при 20°С.
Відповідь: 90,8г.
12. Визначити масу води, в якій треба розчинити речовину CuSO4·5H2O масою 91г, щоб при 30°C утворився насичений розчин CuSO4, якщо коефіцієнт розчинності його за цієї температури дорівнює 0,25.
Відповідь: 200,2г.
13. Визначити масу речовини Al2(SO4)3·18H2O, яка викристалізується при охолодженні насиченого при 100°С розчину Al2(SO4)3 масою 945г до 20°С, якщо коефіцієнти розчинності його дорівнюють відповідно 0,890 і 0,364.
Відповідь: 781,7г.
14. Визначити масову частку речовини КСl у насиченому при 20°С розчині калій хлориду, якщо коефіцієнт розчинності КСl за цієї температури дорівнює 0,34.
Відповідь: 25,37%.
15. Визначити масову частку речовини натрій гідроксиду у розчині, який утворюється при розчиненні Na2O масою 24,8г у розчині масою 350,4г з масовою часткою речовини натрій гідроксиду 8,00%.
Відповідь: 16%.
16. Яку масу бури Na2B4O7·10 H2O треба взяти, щоб приготувати водний розчин масою 4кг з масовою часткою Na2B4O7 5%?
Відповідь: 379,6г.
17. Яку масу CuSO4·5Н2О необхідно додати до розчину об’ємом 0,5дм3 з масовою часткою речовини CuSO4 4,00% і густиною розчину 1,040г/см3, щоб одержати розчин з масовою часткою речовини CuSO4 16,00%?
Відповідь: 130г.
18. Газ гідроген хлорид, одержаний дією надлишку концентрованої сульфатної кислоти на тверду речовину натрій хлорид кількістю речовини 2 моль, розчинили у воді об’ємом 0,3дм3. Визначити масову частку речовини гідроген хлориду в отриманому розчині.
Відповідь: 19,57%.
19. До якого об’єму треба розбавити водою розчин сульфатної кислоти об’ємом 1,25дм3, щоб зменшити його молярну концентрацію еквівалента речовини H2SO4 від 0,8 до 0,25моль/дм3 (fекв(H2SO4)=½)?
Відповідь: 4дм3.
20. Розчин натрій гідроксиду об’ємом 2дм3 з молярною концентрацією речовини NaOH 0,6моль/дм3 змішали з розчином калій гідроксиду об’ємом 3дм3 з молярною концентрацією речовини КОН 1моль/дм3. Визначити молярну концентрацію кожної речовини в отриманому розчині.
Відповідь: с(NaOH)=0,24моль/дм3; с(КОН)=0,60моль/дм3.
21. В одному об’ємі води при 20°С розчиняється 702 об’єми амоніаку (н.у.). Визначити масову частку речовини амоніаку у насиченому при 20°С розчині цього газу у воді.
Відповідь: 34,80%.
22. Залізну платівку масою 100г занурили у розчин купрум(ІІ) сульфату масою 250г з масовою часткою розчиненої речовини CuSO4 20,00%. Через деякий час платівку вийняли з розчину, промили, висушили і зважили. Її маса стала рівною 102г. Розрахувати масові частки розчинених речовин у розчині після видалення з нього металічної платівки.
Відповідь: w(FeSO4)=15,32% ; w(CuSO4)= 4,00%.
23. При розчиненні сплаву магнію з алюмінієм масою 0,39г у розчині хлоридної кислоти масою 50г з масовою часткою речовини НСl 5% виділився газ об’ємом 448см3 (н.у.). Обчислити масові частки речовин кожного металу в сплаві і масові частки кожної речовини в отриманому розчині.
Відповідь: 0,12г ; 0,27г; 30,77%; 69,33%.
24. Визначити молярну концентрацію еквівалента речовини HNO3 у розчині нітратної(V) кислоти з масовою часткою речовини HNO3 44%, якщо густина розчину дорівнює 1,277г/см3.
Відповідь: 8,9187моль/дм3.
25. Визначити молярну концентрацію еквівалента речовини калій гідроксиду у розчині з масовою часткою речовини КОН 80%, якщо густина розчину дорівнює 1,065г/см3.
Відповідь: 15,2143моль/дм3.
26. Після встановлення рівноваги реакції між ацетатною кислотою і етанолом з початковими кількостями речовин по 1 моль одержали 0,667 моль етилацетату. Обчислити константу рівноваги реакції.
Відповідь: 4,0.
27. Константа рівноваги реакції А+BDD+Е дорівнює 4. Визначити вихід (%) продукту реакції D, якщо для проведення реакції взяли 3дм3 розчину речовини А (с(А)= 4,0моль/дм3) і 7дм3 розчину речовини B (с(В) = 2,0моль/дм3).
Відповідь: 70,00%.
28. У системі А+2ВDС рівноважні концентрації становлять (в моль/дм3): [A]=0,06; [B]=1,12; [C]=0,216. Знайти початкові молярні концентрації речовин А і В.
Відповідь: с(А) =0,276моль/дм3; с(В)= 0,552моль/дм3.
29. За деякої температури швидкість прямої реакції А2+В2 D 2АВ становить 0,16, зворотної - 0,0047. Знайти значення константи рівноваги цієї реакції.
Відповідь: 34.
30. Ступінь дисоціації ацетатної кислоти у водному розчині з молярною концентрацією СН3СООН 0,1моль/дм3 становить 1,3%. Знайти масу речовини гідроген-іонів у цьому розчині об’ємом 1дм3.
Відповідь: 1,32·10–3г.
31. Константа дисоціації гідроген ціаніду у водному розчині становить 5·10–10. Визначити молярну концентрацію речовини гідроген-іонів у розчині ціанідної кислоти с(НСN)=0,5моль/дм3.
Відповідь: 1,58·10–5.
32. Визначити константу дисоціації ацетатної кислоти у розчині з масовою часткою речовини СН3СООН 3% і ступенем дисоціації 0,6%.
Відповідь: 1,8·10–5.
33. Буферна суміш утворена з 50см3 розчину СН3СООН (с(СН3СООН=0,1моль/дм3) і 20см3 розчину СН3СООNa (c(CH3COONa=0,2моль/дм3). Обчислити молярну концентрацію гідроген-іонів у цьому розчині і pH розчину.
Відповідь: 2,17·10–5моль/дм3; 4,66.
34. Обчислити активність йонів Mg2+ і Al3+ у розчині, в 1дм3 якого міститься 0,1 моль MgSO4 і Al(NO3)3.
Відповідь; а(Mg2+)=0,063моль/дм3 ; а(Аl3+)=0,018моль/дм3.
35. Визначити молярну концентрацію речовини амоній гідроксиду (NH3·H2O) у розчині, якщо ступінь дисоціації його дорівнює 1,3%.
Відповідь: 1,041моль/дм3.
36. Визначити активність гідроксид-іонів у розчині натрій гідроксиду з молярною концентрацією речовини NaOH 0,06моль/дм3.
Відповідь: 0,05моль/дм3.
37. Яку кількість речовини ацетатної кислоти необхідно додати до 1дм3 розчину натрій ацетату з молярною концентрацією речовини 1моль/дм3, щоб pH отриманого розчину став 7,0?
Відповідь: 0,00575моль.
38. Визначити константу дисоціації НСlО, якщо ступінь дисоціації його у розчині з молярною концентрацією речовини НСlО 0,2моль/дм3 становить 0,053%.
Відповідь: 5,62·10–8.
39. Обчислити pH у розчині амоній гідроксиду з молярною концентрацією речовини 0,01моль/дм3.
Відповідь: 10,62.
40. Визначити с(Н+), с(  ), c(
), c(  ), у розчині H2SO4 з молярною концентрацією речовини H2SO4 0,01моль/дм3.
), у розчині H2SO4 з молярною концентрацією речовини H2SO4 0,01моль/дм3.
Відповідь: с(Н+)=1,45·10–2моль/дм3; с(  )=5,5·10–3моль/дм3;
)=5,5·10–3моль/дм3;
c(  )=4,5·10–3моль/дм3.
)=4,5·10–3моль/дм3.
41. Обчислити pH розчину амоніаку з молярною концентрацією речовини (NH3·H2O) 0,3моль/дм3.
Відповідь: 11,36.
42. Обчислити pH розчину, одержаному при змішуванні 150см3 розчину форміатної кислоти (с(НСООН)=0,08моль/дм3) і 180 см3 розчину натрій форміату (с(НСООNa)=0,15моль/дм3).
Відповідь: 4,10.
43. Який об’єм розчину хлоридної кислоти з молярною концентрацією речовини гідроген хлориду 0,1моль/дм3 необхідно додати до розчину амоніаку (NH3) об’ємом 50см3 з молярною концентрацією речовини 0,25моль/дм3, щоб отримати розчин з pH 9?
Відповідь: 79,70см3.
44. Який об’єм розчину натрій гідроксиду з молярною концентрацією речовини NaOH 0,1моль/дм3 необхідно додати до 50см3 розчину NaH2PO4 з молярною концентрацією речовини NaH2PO4 0,2моль/дм3, щоб pH був рівним 7,0?
Відповідь: 38,10см3.
45. Яку масу речовини натрій карбонату треба додати до 50см3 розчину натрій гідрокарбонату з молярною концентрацією речовини NaHCO3 0,25моль/дм3, щоб отримати розчин з pH 10?
Відповідь:0,6341г.
46. Який об’єм розчину хлоридної кислоти з молярною концентрацією речовини гідроген хлориду 0,1моль/дм3 необхідно додати до розчину, що містить натрій карбонат масою 1г у 250см3 води, щоб отримати розчин з pH 10?
Відповідь: 16,30см3.
47. Який об’єм розчину калій гідроксиду з молярною концентрацією речовини КОН 0,5моль/дм3 треба додати до 50см3 розчину К2НРО4 з молярною концентрацією речовини 1моль/дм3, щоб отримати розчин з pH 11?
Відповідь: 4,77 см3.
48. Яку масу речовини натрій дигідрогенфосфату (NaH2PO4) необхідно додати до 250см3 розчину натрій гідроксиду з молярною концентрацією речовини NaOH 0,15моль/дм3, щоб отримати розчин з pH 7,0 ?
Відповідь: 11,7967г.
49. На яку величину зміниться pH розчину , що складається з NH3·H2O і NH4Cl з молярними концентраціями речовин 1,1моль/дм3, якщо до нього додати розчин гідроген хлориду з молярною концентрацією речовини НСl 0,1моль/дм3?
Відповідь: на 0,08.
50. Як зміниться ступінь дисоціації форміатної кислоти, якщо до 400см3 її розчину з молярною концентрацією речовин НСООН 0,5моль/дм3 додати розчин натрій форміату об’ємом 100см3, що містить речовину HCOONa масою 3,4г?
Відповідь: зменшиться в 10,54 рази.
51. Який pH у розчині амоній гідроксиду (NH3·H2O) з молярною концентрацією речовини амоніаку NH3 0,05моль/дм3, до 1дм3 якого додали амоній хлорид кількістю речовини 0,1моль/дм3 (f( 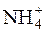 )=0,76)?
)=0,76)?
Відповідь: 9,0.
52. Обчислити pH розчину, що містить 0,5моль/дм3 речовини Н3РО4 і 0,25моль/дм3 речовини NaH2PO4.
Відповідь: 1,85.
53. Обчислити рівноважні молярні концентрації H2S і йонів HS– у розчині сульфідної кислоти з молярною концентрацією речовини H2S 0,1моль/дм3 при pH=5,0.
Відповідь: [H2S]=1,3·10–3моль/дм3; [HS–]=9,9·10–2моль/дм3.
54. pH розчину, через який був пропущений гідроген сульфід H2S, дорівнює 8,3. Обчислити рівноважні молярні концентрації йонів HS– і S2– у цьому розчині.
Відповідь: [HS–]=9,52·10–2моль/дм3; [S2–]=1,9·10–8моль/дм3.
55. Обчислити рівноважні молярні концентрації H2SO3 і йонів  у розчині сульфатної(ІV) кислоти з молярною концентрацією речовини H2SO3 0,1моль/дм3 при pH 4,0.
у розчині сульфатної(ІV) кислоти з молярною концентрацією речовини H2SO3 0,1моль/дм3 при pH 4,0.
Відповідь: [H2SO3]=7·10–4моль/дм3; [  ]=9 ,93·10–2моль/дм3.
]=9 ,93·10–2моль/дм3.
56. Яка молярна концентрація речовини Pb2+ залишається у розчині при осадженні його у вигляді плюмбум сульфату дією еквівалентної кількості сульфатної кислоти?
Відповідь: 1,26·10–4моль/дм3.
57. До 50см3 розчину аргентум нітрату (с(AgNO3)=1,7·10–4моль/дм3) додали 150см3 розчину натрій хлориду (с(NaCl)=0,01моль/дм3). Обчислити молярні концентрації речовин Ag+ і Cl– у отриманому розчині.
Відповідь: с(Ag+)=2,37·10–8моль/дм3; с(Сl–)=7,5·10–3моль/дм3).
58. Обчислити молярну концентрацію речовини Ba2+ у розчині, якщо до 100см3 розчину барій хлориду (с(ВаСl2)=0,05моль/дм3) додали 100см3 розчину натрій сульфату (с(Na2SO4)= =0,06моль/дм3).
Відповідь: 2,2·10–8моль/дм3.
59. Обчислити молярну концентрацію речовини Mg2+-іона у насиченому розчині амоній магній фосфату (MgNH4PO4), в якому молярна концентрація речовини амоній-іона дорівнює 0,5моль/дм3, а йона 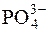 – 0,001моль/дм3.
– 0,001моль/дм3.
Відповідь: 5·10–10моль/дм3.
60. Добуток розчинності стронцій сульфату дорівнює 3,2·10–7. Обчислити, в якому об’ємі насиченого розчину міститься Sr2+ кількістю 0,56 моль?
Відповідь: 1м3.
61. Добуток розчинності аргентум фосфату дорівнює 1,3·10–20. Обчислити розчинність (моль/дм Дата добавления: 2015-12-26; просмотров: 10328;
