Лекция №5: Химическая связь. Основные типы химической связи. Методы ВС и МО.
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кристаллах, характеризуемый определенной энергией. При всем многообразии химических связей их природа едина и носит электростатический характер.
Механизм образования химической связи может быть смоделирован различными способами. Простейшим является метод валентных связей (ВС), предложенный Льюисом.
Метод валентных связей рассматривает химическую связь как результат притяжения ядер двух атомов к одной или нескольким общим для них электронным парам. Такая двух электронная и двух центровая связь, локализованная между двумя атомами, называется ковалентной.
Принципиально возможны два механизма образования ковалентной связи:
1. спаривание электронов двух атомов при условии противоположной ориентации их спинов;
2. донорно-акцепторное взаимодействие, при котором общей становится готовая электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора).
Причиной образования любого типа химической связи является понижение энергии системы, которая сопровождает этот процесс. Разность энергии начального и конечного состояния системы называется энергией связи (Есв) и определяется количеством теплоты, выделяющейся при её образовании. Энергия ковалентных химических связей оценивается значениями порядка 125-1050 кДж/моль.
Расстояние между ядрами двух связанных атомов называется длиной связи. Длина и энергия связи зависят от её кратности, которая определяется числом электронных пар, связывающих два взаимодействующих атома. Чем кратность связи выше, тем больше энергия связи и меньше длина.
Ковалентную связь характеризуют насыщаемость, направленность и полярность.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определённого числа связей, которое обычно лежит в пределах: от 1 до 6. Общее число валентных орбиталей в атоме определяет максимально возможную ковалентность элемента. Число уже использованных для этого орбиталей определяет ковалентность элемента в данном соединении.
Если атом образует все связи только за счёт спаривания электронов, то обычно говорят просто о его валентности, которая определяется числом неспаренных электронов в основном или возбуждённом состояниях.
Если атом образует связи по обменному и донорно-акцепторному механизмам, то говорят о ковалентности.
В таком случае валентность бора в молекуле BF3 равна трём, а в комплексном ионе BF4 – ковалентность равна четырем.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счёт возможно большей электронной плотности между ядрами взаимодействующих атомов. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s- электронные орбитали, поскольку они имеют сферическую форму. Перекрывание орбиталей может осуществляться различным образом: s, p, d- способами. При образовании s- связи возникает одна область перекрывания орбиталей, осе симметричная относительно линии, соединяющей ядра – межядерной оси.
После образования между двумя атомами s- связи для остальных электронных орбиталей той же формы и с тем же главным квантовым числом остаётся только возможность бокового перекрывания по разные стороны от линии связи, перпендикулярно которой в этом случае проходит узловая плоскость. В результате образуются p- или d- связи. В первом случае возникают две, во втором – четыре области перекрывания.
Число s- связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа.
Связи, образованные атомом за счёт орбиталей с различным значением орбитального квантового числа, должны быть энергетически неравноценными, что, однако, не подтверждается экспериментом. В подобных случаях пользуются представлением о гибридизации орбиталей, согласно которым при образовании связи орбитали разной симметрии смешиваются и превращаются в гибридные орбитали одинаковой формы и усредненной энергии, что обеспечивает равноценность образуемых ими связей. В гибридизации могут участвовать не только одноэлектронные, но так же двухэлектронные атомные орбитали. В этом случае, на гибридных орбиталях остаётся такое же число неподеленных электронных пар, которое было на исходных атомных орбиталях.
Геометрическая конфигурация молекул полностью определяется типом гибридизации орбиталей центрального атома только при условии, что все гибридные атомные орбитали участвуют в образовании связей. Если же хотя бы на одной из них остаётся неподеленная электронная пара, то конфигурация, определяемая типом гибридизации не реализуется. Приблизительное значение валентных углов в различных молекулах составляет 90°. Значение валентного угла в молекуле воды, например, равно 104,5°.
Метод валентных связей позволяет объяснить полярность ковалентной связи. Если электроотрицательность атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается симметрично по отношению к обоим ядрам. Такая ковалентная связь называется неполярной (гомоядерные молекулы). Например, в молекуле Н2 связь ковалентная неполярная.
Если электроотрицательность атомов различная, то электронная пара смещается в сторону более электроотрицательного атома. В этом случае центры (+) и (-) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов (d+ и d-), расстояние между которыми (l) называют длиной диполя. Подобные ковалентные связи называют полярными. Степень полярности такой связи оценивается значением электрического момента диполя- m, равного произведению эффективного заряда на длину диполя
m=q·l.
Наконец, если разница электроотрицательностей (Dc) превышает 1,9, то образуется ионная связь – предельный случай ковалентной полярной связи. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.
Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов. Например, в молекуле NaCl связь относится к ионной.
Вторым способом объяснения ковалентной химической связи является метод молекулярных орбиталей. В этом случае химическая связь рассматривается как результат распределения электронов в молекуле по соответствующим молекулярным орбиталям, которые находят в наиболее простом приближении методом линейной комбинации атомных орбиталей. Из n-го числа атомных орбиталей образуется n-ое число молекулярных орбиталей.
Перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей, одна из которых имеет более низкую, а другая более высокую энергию, чем первоначальные атомные орбитали. Соответственно эти молекулярные орбитали называют связывающей и разрыхляющей. Заполнение молекулярных орбиталей происходит так же как и атомных, т.е. в соответствии с принципом Паули и правилом Хунда.
Водородной называют связь образуемую атомом водорода, который ковалентно связан с атомом сильно электроотрицательного элемента А и другим подобным атомом В:
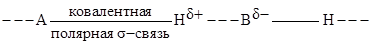
Чем выше электроотрицательность атомов А и В, тем больше эффективные заряды 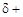 на атоме Н и
на атоме Н и 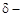 на атоме В, а следовательно, тем сильнее между ними электростатическое взаимодействие и прочнее водородная связь.
на атоме В, а следовательно, тем сильнее между ними электростатическое взаимодействие и прочнее водородная связь.
Силы взаимодействия между молекулами, которые называют ван-дер-ваальсовыми или межмолекулярными, обусловлены тремя видами взаимодействия: ориентационное, индукционное и дисперсионное. С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают и, как следствие, повышаются температуры плавления и кипения веществ.
Под I-ым потенциалом ионизации понимают энергию отрыва от атома первого электрона, под II-ым потенциалом ионизации понимают энергию отрыва от атома второго электрона и т.д. Величина потенциала ионизации явля-ется мерой такого свойства элемента, как эффекта экранирования заряда ядра. Последовательные потенциалы ионизации атома возрастают.
Лекция №6: Периодический закон и периодическая система элементов Д.И. Менделеева.
В настоящее время периодический закон формулируется следующим образом: «свойства простых веществ, а также свойства и формы соединений элементов находящихся в периодической зависимости от зарядов ядра атомов элементов».
Периодичность в изменении свойств химических элементов, расположенных в порядке возрастания заряда ядра их атомов, является результатом периодического повторения структуры внешнего электронного слоя, что связанно с последовательным заполнением атомных орбиталей в соответствии с принципом наименьшей энергии. Каждый элемент в одно и то же время обладает как набором сугубо индивидуальных свойств, связанных с особенностью строения его атомов, так и совокупностью свойств, сходных со свойствами его электронных аналогов.
Химический элемент – это вид атомов, характеризующихся определённым зарядом ядра равным порядковому номеру в периодической системе. Он может существовать как в форме изолированных атомов или ионов, так и в форме атомов и ионов в составе соединений с другими атомами.
Химические соединения состоят из атомов или ионов, находящихся в связанном состоянии, и характеризуются определённым составом и строением. Они могут существовать в различных формах и состояниях, в виде как кристаллов, так и изолированных молекул.
Периодическая система Д.И. Менделеева – это наглядное графическое изображение периодического закона. Наиболее распространена её так называемая короткопериодная форма.
В структуре таблицы (системы) выделяют периоды, группы и подгруппы.
Периодом называют горизонтальную совокупность элементов, расположенных в порядке возрастания заряда ядра. Каждый период начинается s - элементом с конфигурацией внешнего электронного уровня ns1 и завершающийся p - элементом с конфигурацией внешнего электронного уровня ns2np6 (кроме первого периода, который заканчивается гелием – 1s2). Номер периода определяется значением главного квантового числа внешнего электронного уровня. Первые три периода называют малыми и состоят они только из s- и p- элементов. Четыре остальных периода называют большими. В составе четвёртого и пятого периодов появляются d- элементы, а в шестой и седьмой периоды входят f- элементы. В связи с закономерным изменением электронного строения атомов в пределах малых периодов свойства элементов изменяются резко, в больших периодах – медленно.
Группой называют совокупность элементов, расположенных в таблице вертикально в порядке возрастания заряда ядра. В периодической системе находится 8 групп т.к. на внешнем электронном уровне не может быть больше восьми валентных электронов. Каждая группа состоит из главной и побочной подгрупп. В состав главных подгрупп входят только s- или p- элементы, а побочных – d- и f- элементы (f- элементы вынесены в отдельные строки внизу таблицы). Атомы элементов одной подгруппы являются полными электронными аналогами, т.е. распределение валентных электронов по уровням полностью совпадает (за некоторыми исключениями, например Nb – 5s14d4 вместо 5s24d3). Атомы элементов группы в целом не являются полными электронными аналогами.
Рассмотрим характер изменения некоторых свойств элементов с изменением заряда ядра их атомов.
Радиусы атомов элементов и ионов – условные величины. Их обычно вычисляют из межатомных (межядерных) расстояний, которые зависят не только от природы атомов, но также и от характера химической связи между ними и от агрегатного состояния вещества.
Атомные радиусы в периоде с увеличением зарядов ядра в основном уменьшаются (что не исключает локальных максимумов) в связи с увеличением сил кулоновского притяжения. Радиусы одинаково заряженных ионов изменяются по такому же закону. В подгруппе с увеличением заряда ядра атомные и ионные радиусы, как правило, увеличиваются, что связанно с увеличением числа электронных уровней.
Энергия ионизации (I) (потенциал ионизации) в периоде возрастает с ростом заряда ядра (хотя и не монотонно т.к. зависит от энергетического состояния электрона), в главных и третьей побочной подгруппах – убывает сверху вниз в связи с появлением нового энергетического уровня. В остальных побочных подгруппах энергия ионизации возрастает с ростом заряда ядра.
Сродством к электрону (Е) – называют энергию, которая выделяется при присоединении дополнительного электрона к атому, иону или молекуле. Максимальным сродством к электрону обладают атомы галогенов. Сродство к электрону зависит не только от заряда атома, но и степени заполнения атомных орбиталей валентных уровней.
Электроотрицательность (ЭО) представляет собой обобщенную характеристику элемента, связанную не с электронами на отдельных орбиталях, а с внешними электронами вообще, определяемую как сумма энергии ионизации и сродства к электрону. Под электроотрицательностью понимают относительную характеристику способности атома, притягивать электронную пару. Относительная электроотрицательность в периоде возрастает и уменьшается в подгруппе с ростом заряда ядра. Относительную ЭО по Полингу определяют как отношение ЭО элемента к ЭО атома лития.
Окислительная способность элемента меняется так же как и электроотрицательность, а восстановительная – наоборот.
Плотность простых веществ в периоде обычно проходит через максимум, лежащий примерно по середине периода и закономерно возрастает в подгруппе с ростом заряда ядра.
Основные свойства высших оксидов и гидроксидов элементов в периоде закономерно ослабляются, что связано с увеличением силы притяжения гидроксид-ионов к центральному атому с ростом заряда его ядра и уменьшением атомного радиуса, а в подгруппе, в основном, усиливаются, потому что атомный радиус элементов возрастает.
Кислотные свойства этих соединений изменяются в обратном направлении. Неметаллические свойства в периоде, как правило усиливаются слева направо, а в подгруппе – ослабевают сверху вниз, металлические – наоборот. Граница между металлами и неметаллами в таблице проходит по диагонали B-At таким образом, что все неметаллы находятся в верхней правой части таблицы (исключение составляют d- элементы).
Дата добавления: 2015-12-26; просмотров: 1714;
