ОСНОВНЫЕ КЛАССИФИКАЦИИ АНТИБИОТИКОВ
По способу получения:
1) природные;
2) синтетические;
3) полусинтетические.
Продуцентами большинства антибиотиков являются:
1) актиномицеты;
2) плесневые грибы;
3) бактерии (полимиксины);
4) высшие растения (фитонциды);
5) ткани животных и рыб (эритрин, эктерицид).
По направленности действия:
1) антибактериальные;
2) противогрибковые;
3) противоопухолевые.
По спектру действия (числу видов микроорганизмов, на которые действуют антибиотики):
1) препараты широкого спектра действия (цефалоспорины 3-го поколения, макролиды);
2) препараты узкого спектра действия (циклосерин, линкомицин, бензилпенициллин, клиндамицин).
По химическому строению:
1) бета-лактамные антибиотики – основу из молекулы составляет бета-лактамное кольцо. К ним относятся:
а) пенициллины – это группа природных и полусинтетических антибиотиков, молекула которых содержит 6-аминопенициллановую кислоту, состоящую из двух колец – тиазолидонового и бета-лактамного. Среди них выделяют:
– биосинтетические (пенициллин G-бензилпенициллин);
– аминопенициллины (амоксициллин, ампициллин, бекампициллин);
– полусинтетические «антистафилококковые» пенициллины (оксациллин, метициллин, клоксациллин, диклоксациллин, флуклоксациллин), основное преимущество которых – устойчивость к микробным бета-лактамазам, в первую очередь стафилококковым;
б) цефалоспорины – это природные и полусинтетические антибиотики, полученные на основе 7-аминоцефалоспориновой кислоты и содержащие цефемовое (также бета-лактамное) кольцо, т. е. по структуре они близки к пенициллинам. Делятся на цефалоспорины:
– 1-го поколения: цепорин, цефалотин, цефалексин;
– 2-го поколения: цефазолин (кефзол), цефамезин, цефамандол (мандол);
– 3-го поколения: цефуроксим (кетоцеф), цефотаксим (клафоран), цефуроксим аксетил (зиннат), цефтриаксон (лонгацеф), цефтазидим (фортум);
– 4-го поколения: цефепим, цефпиром (цефром, кейтен) и др.
в) монобактамы – азтреонам (азактам, небактам);
г) карбопенемы – меропенем (меронем) и имипинем;
2) аминогликозиды. Они содержат аминосахара, соединенные гликозидной связью с остальной частью (агликоновым фрагментом) молекулы. К ним относятся: стрептомицин, гентамицин (гарамицин), канамицин, неомицин, мономицин, сизомицин, тобрамицин (тобра) и полусинтетические аминогликозиды – спектиномицин, амикацин (амикин), нетилмицин (нетиллин);
3) тетрациклины. Основу молекулы составляет полифункциональное гидронафтаценовое соединение с родовым название тетрациклин. Среди них имеются природные тетрациклины – тетрациклин, окситетрациклин (клинимицин) и полусинтетические тетрациклины – метациклин, хлортетрин, доксициклин (вибрамицин), миноциклин, ролитетрациклин;
4) макролиды. Препараты этой группы содержат в своей молекуле макроциклическое лактоновое кольцо, связанное с одним или несколькими углеводными остатками. К ним относятся: эритромицин, олеандомицин, рокситромицин (рулид), азитромицин (сумамед), кларитромицин (клацид), спирамицин, диритромицин;
5) линкозамиды. К ним относятся: линкомицин и клиндамицин. Фармакологические и биологические свойства этих антибиотиков очень близки к макролидам, и, хотя в химическом отношении это совершенно иные препараты, некоторые медицинские источники и фармацевтические фирмы – производители химиопрепаратов, например делацина С, – относят линкозамины к группе макролидов;
6) гликопептиды. Препараты этой группы в своей молекуле содержат замещенные пептидные соединения. К ним относятся: ванкомицин (ванкацин, диатрацин), тейкопланин (таргоцид), даптомицин;
7) полипептиды. Препараты этой группы в своей молекуле содержат остатки полипептидных соединений, к ним относятся: грамицидин, полимиксины М и В, бацитрацин, колистин;
8) полиены. Препараты этой группы в своей молекуле содержат несколько сопряженных двойных связей. К ним относятся: амфотерицин В, нистатин, леворин, натамицин;
9) антрациклиновые антибиотики. К ним относятся противо-опухолевые антибиотики: доксорубицин, карминомицин, рубомицин, акларубицин.
Есть еще несколько достаточно широко используемых в настоящее время в практике антибиотиков, не относящихся ни к одной из перечисленных групп – фосфомицин, фузидиевая кислота (фузидин), рифампицин. В основе антимикробного действия антибиотиков, как и других химиотерапевтических средств, лежит нарушение метаболизма микробных клеток.
Пенициллины. Обладают широким спектром антибактериального действия, проявляя как бактериостатическую, так и бактерицидную активность в отношении многих грамположительных микроорганизмов (стафилококков, пневмококков, стрептококков), некоторых грамотрицательных кокков (гонококков, менингококков), палочек сибирской язвы, клостридий, спирохет и некоторых грибов. Широкое медицинское применение пенициллинов связано с их относительно низкой токсичностью для теплокровных, хотя в ряде случаев эти антибиотики вызывают аллергические заболевания и анафилактический шок. Молекула пенициллина содержит β-лактам-тиазолидиновую бициклическую систему пенама и имеет строго необходимую для проявления биологической активности конфигурацию (рис. 61).
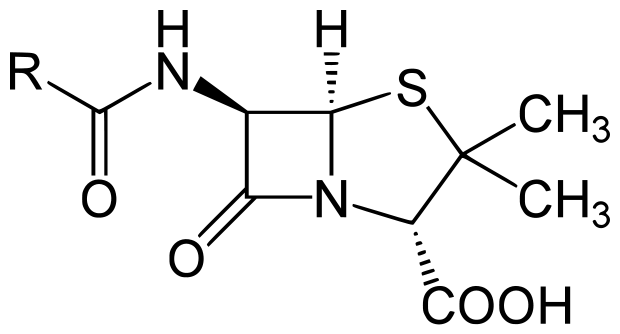
Рис. 61. Общая структурная формула пенницилинов
Цефалоспорины.Ооказывают бактерицидное действие. Имеют широкий спектр антимикробной активности, хорошие фармакокинетические характеристики, низкую токсичность и хорошую переносимость (в том числе при применении в максимальных дозах). Общая формула цефалоспоринов представлена на рис. 62. Выделяют четыре поколения цефалоспоринов. В ряду от I к IV поколению расширяется спектр действия и повышается уровень антимикробной активности в отношении грамотрицательных бактерий и пневмококков, и немного снижается активность в отношении стафилококков от I к III поколению. Механизм действия β-лактамных антибиотиков состоит в подавлении синтеза бактериальной клеточной стенки.
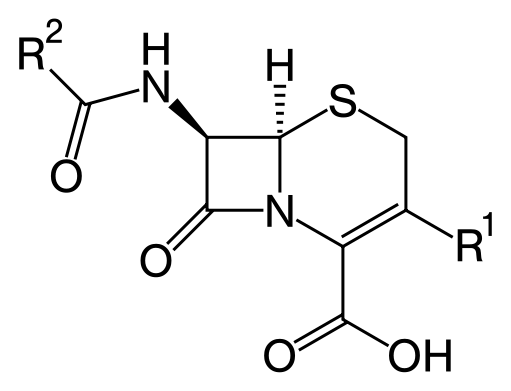
Рис. 62. Общая формула цефалоспоринов.
Аминогликозиды.По широте клинического применения группа антибиотиков аминогликозидов занимает четвертое место после β-лактамов, тетрациклинов и неполиеновых макролидов. Стрептомицин (рис. 63), обнаруженный в результате тщательно спланированной программы поиска препаратов, активных против грамотрицательных бактерий, оказался первым эффективным антибиотиком для лечения туберкулеза; наряду с другими аминогликозидами он используется также для борьбы с заболеваниями, вызываемыми различными видами Pseudomonas и Proteus, а иногда также Streptomyces и Staphylococcus.
Рис. 63. Структурная формула стрептомицина
Аминогликозиды – многочисленное семейство антибиотиков, охватывающее более 100 природных соединений, продуцируемых микроорганизмами родов Streptomyces, Micromonospora и Bacillus, a также большое число полусинтетических аналогов. Их объединяет наличие в молекуле одного из шестичленных карбоциклических аминоспиртов (аминоинозитов), гликозилированных одним или несколькими обычными или специфическими аминосахарами.
Тетрациклины. Занимают второе место после β-лактамных по широте клинического применения. Они высокоактивны против грамположительных и большинства грамотрицательных бактерий, риккетсий и микоплазм и применяются для борьбы с пневмонией, дизентерией, коклюшем, гонореей, бруцеллезом, туляремией, сыпным и возвратным тифом, холециститом, менингитом и другими инфекционными заболеваниями, а также гнойными осложнениями в хирургии. Первый тетрациклиновый антибиотик хлортетрациклин (ауреомицин) выделен Б. Даггером в 1948 г. из Streptomyces aureofaciens, в 1950 г. описан окситетрациклин (террамицин) из S. rimosus, a позднее получен (как каталитическим восстановлением хлортетрациклина, так и биосинтезом) тетрациклин (рис. 64) и остальные 6 природных тетрациклинов.
Рис. 64. Структурная формула тетрациклина.
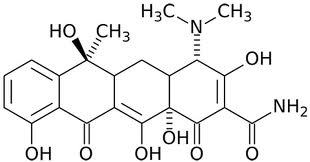
Макролиды. Представляют собой класс антибиотиков, основу химической структуры которых составляет макроциклическое лактонное кольцо. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-членные (эритромицин, рокситромицин, кларитромицин), 15-членные (азитромицин) и 16-членные (мидекамицин, спирамицин, джозамицин). Основное клиническое значение имеет активность макролидов в отношении грамположительных кокков и внутриклеточных возбудителей (микоплазмы, хламидии, кампилобактеры, легионеллы). Макролиды относятся к числу наименее токсичных антибиотиков. Химическая структура молекулы эритромицина представлена на рис. 65.
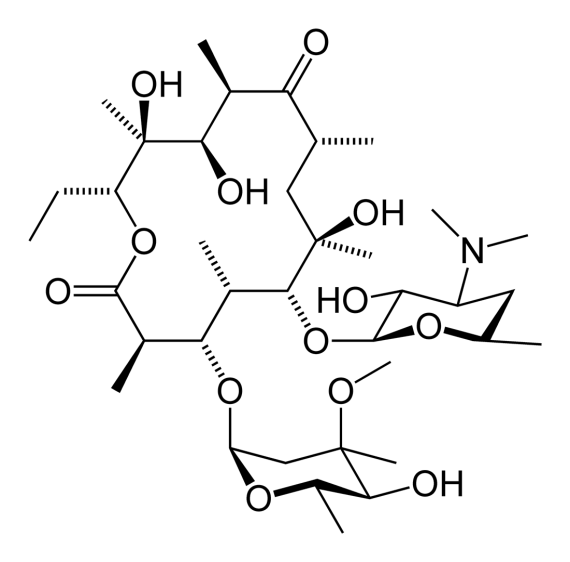
Рис. 65. Химическая структура молекулы эритромицина.
Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Антибактериальные макролиды обладают бактериостатическим действием, хотя при больших концентрациях могут вызывать гибель чувствительных клеток.
Среди макролидов можно выделить важную подгруппу антибиотиков, называемых ансамакролидами. Их биологическая активность связана с подавлением биосинтеза нуклеиновых кислот. Характерной чертой химического строения ансамакролидов является наличие алифатической лактамной цепи, которая, как ручка корзины (от лат. ansa – ручка), связывает два несмежных положения нафталинового или бензольного кольца. Наиболее важные представители первой, нафталиновой группы – рифамицины В и SV, а также полусинтетический рифампицин. Рифампицин – наиболее эффективный антибиотик для лечения туберкулеза (рис. 66).
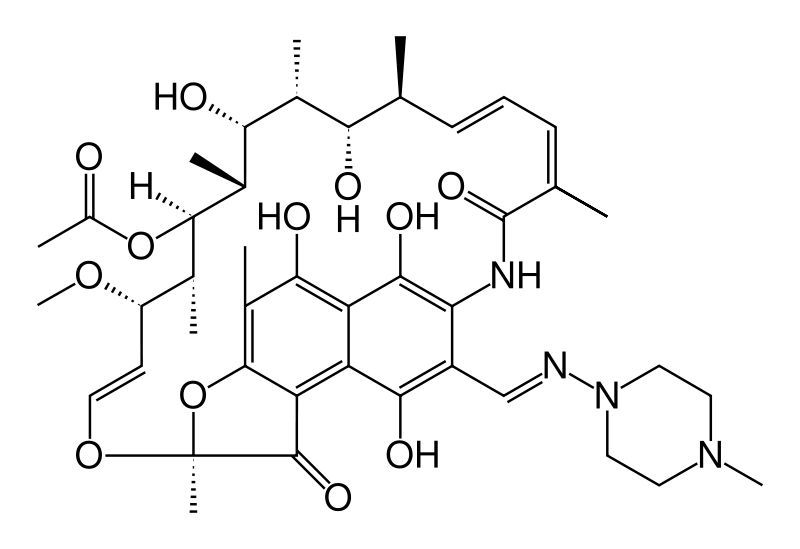
Рис. 66. Структура рифампицина
Механизм действия ансамакролидов уникален. Они подавляют активность ДНК-зависимых РНК-полимераз из клеток бактерий и совершенно не взаимодействуют с РНК-полимеразами млекопитающих. Конкретная мишень нафталиновых ансамакролидов – β-субъединицы фермента, с которыми они образуют очень прочные нековалентные комплексы, из-за чего нарушается образование второй и третьей фосфодиэфирных связей в РНК.
Антифунгальные антибиотики.Среди них наиболее важную группу составляют полиеновые макролиды. В настоящее время ниболее широко распространенными являются четыре антибиотика этой группы: амфотерицин В, нистатин, леворин и трихомицин; в мире употребляются в основном первые два из них и кандицидин, главный компонент которого идентичен леворину А2. Для полиеновых макролидов характерно наличие в молекуле сопряженной системы двойных связей, по количеству которых их классифицируют как три-, тетра-, пента-, гекса- или гептаены. Широко применяемые макролидные антибиотики обладают цвиттер-ионным характером и поэтому плохо растворимы в воде. Нистатин и леворин применяются только местно и плохо всасываются при оральном применении. Внутривенно, для лечения системных микозов, применяют только амфотерицин В. Для улучшения растворимости полиеновых антибиотиков предложено использовать их N-ацетильные и некоторые другие производные, например н-бутиламиды, четвертичные соли и N-диметиламинометилиденовые производные метиловых эфиров. В отличие от всех рассмотренных выше антибиотиков, мишенью действия полиеновых макролидов является не конкретная макромолекула, а важнейшая часть клетки в целом – ее мембрана.
Антрациклины. Важнейшая группа антибиотиков, использующихся в химиотерапии злокачественных опухолей. Они активны также в отношении грамположительных бактерий, грибов и вирусов, но обладают слишком большой токсичностью, в особенности кумулятивной кардиотоксичностью, которая исключает их применение в химиотерапии инфекционных заболеваний. Антрациклины представляют собой сочлененные с карбоциклическим кольцом антрахиноны, несущие различное количество заместителей и гидроксильных групп, одна из которых гликозилирована специфическим моносахаридом или трисахаридом.
Наиболее широкое применение в клинической практике находят три антрациклина: дауномицин, адриамицин (доксорубицин) и карминомицин. Большая часть антрациклинов, продуцируется различными видами Streptomyces, и была открыта в 1956–1964 гг. В основе строения всех указанных антибиотиков – антрахиноновая структура (рис. 67).
| антрациклин | R1 | R2 |
| дауномицин | -OCH3 | -H |
| адриамицин | -OCH3 | -OH |
| карминомицин | -H | -H |
Рис. 67. Общая структура антрациклиновых антибиотиков
По механизму действия антрациклины близки актиномицину D: подавляют ДНК-зависимый синтез РНК (ее элонгацию) и гораздо слабее влияют на репликацию. В литературе имеются сведения, что некоторые аналоги дауномицина проявляют высокую противоопухолевую активность, ингибируют синтез РНК, не образуя комплексов с ДНК.
Среди пртивоопухолевых антибиотиков можно также отметить стрептонигрин(рис. 68). Этот антибиотик широкого спектра действия из Streptomyces flocculus описан в 1959–1960 гг. К. Рао и В. Кулленом, а затем выделен и введен в онкологическую практику под названием брунеомицина или рубихромомицина.
Рис. 68. Структурная формула стрептонигина
Строение антибиотика установлено в 1963 г. К. Рао, К. Биманом и Р. Б. Вудвордом. Антибиотик вызывает одиночные разрывы в ДНК. Он связывается с ней как в хинолинхинонной, так и в восстановленной формах, образуя два типа комплексов, диализуемых и недиализуемых, причем последние содержат одну молекулу антибиотика на 2000 п. о. Механизм его действия, вероятно, состоит в том, что он восстанавливается НАДН до гидрохинона и далее окисляется в семихинон кислородом воздуха с одновременным образованием супероксидных радикалов (–О–О·), которые и вызывают гибель клеток.
Митомицины А, В и С, а также порфиромицин представляют собой комплекс противоопухолевых антибиотиков, продуцируемых несколькими видами Streptomyces. Впервые они обнаружены японскими исследователями в 1956 г., а их строение определено химическим и рентгеноструктурным анализом в 1962–1976 гг. Описаны полные синтезы митомицинов и множества их производных и аналогов. Из них ряд соединений проявляет большую активность против отдельных видов опухолей (лейкопения) и меньшую токсичность. Отличительной чертой химического строения митомицинов является присутствие в молекулах азиридинового цикла, редко встречающегося среди природных соединений. Общая структура митомицинов представлена на рис. 69.
Рис. 69. Общая структура митомицинов
Отличительной чертой химического строения митомицинов является присутствие в молекулах азиридинового цикла, редко встречающегося среди природных соединений. Митомицины – быстродействующие бактерицидные и цитотоксичные реагенты, и устойчивость к ним клеток некоторых бактерий может быть объяснена только барьерами проницаемости. Мишенью действия митомицинов является ДНК – они быстро подавляют репликацию и вызывают разрушение существующей ДНК двумя путями: во-первых, образованием модифицированных пуриновых звеньев (одно звено на 200 - 300 пар оснований) и, во-вторых, бифункциональным связыванием двух комплементарных цепей ДНК. Интересно, что вирусная ДНК, в отличие от ДНК клеток хозяина, митомицинами почти не разрушается. Обязательным условием действия митомицинов является их предварительное восстановление с помощью НАДН in vivo.
Дата добавления: 2015-12-22; просмотров: 2592;
