АКТИВНОСТЬ ФЕРМЕНТОВ И ФАКТОРЫ, НА НЕЕ ВЛИЯЮЩИЕ. ПРИНЦИПЫ ФЕРМЕНТАТИВНОЙ КИНЕТИКИ
Под активностью фермента понимают такое его количество, которое катализирует превращение определенного количества субстрата в единицу времени. Для выражения активности препаратов ферментов используют две альтернативные единицы: международную (МЕ) и «катал» (кат). За международную единицу активности фермента принято такое его количество, которое катализирует превращение 1 мкмоля субстрата в продукт за 1 мин в стандартных условиях (обычно оптимальных). 1 катал обозначает количество фермента, катализирующее превращение 1 моля субстрата за 1 с. 1 кат = 6∙107 МЕ. При бимолекулярной реакции A + В = С + D за единицу активности фермента принимают такое его количество, которое катализирует превращение одного мкмоля А или В или двух мкмолей А (если В = А) за 1 мин.
Часто ферментные препараты характеризуются удельной активностью, которая отражает степень очистки фермента. Удельная активность – это число единиц активности фермента, приходящихся на 1 мг белка.
Молекулярная активность (число оборотов фермента) – число молекул субстрата, подвергающееся превращению одной молекулой фермента за 1 мин при полном насыщении фермента субстратом. Она равна числу единиц активности фермента, деленному на количество фермента, выраженное в мкмолях. Понятие молекулярной активности применимо только для чистых ферментов.
Когда известно количество активных центров в молекуле фермента, вводится понятие активности каталитического центра. Характеризуется числом молекул субстрата, которое подвергается превращению за 1 мин в расчете на один активный центр.
Активность ферментов сильно зависит от внешних условий, среди которых первостепенное значение имеют температура и рН среды. Повышение температуры в интервале 0 - 50°С обычно приводит к плавному увеличению ферментативной активности, что связано с ускорением процессов формирования фермент-субстратного комплекса и всех последующих событий катализа. При повышении температуры на каждые 10°С скорость реакции увеличивается примерно вдвое (правило Вант-Гоффа). Однако дальнейшее повышение температуры (>50°С) сопровождается увеличением количества инактивированного фермента за счет денатурации его белковой части, что выражается в снижении активности. Каждый фермент характеризуется температурным оптимумом – значением температуры, при котором регистрируется наибольшая его активность.
Зависимость активности ферментов от значения рН среды имеет сложный характер. Для каждого фермента характерен оптимум рН среды, при котором он проявляет максимальную активность. При удалении от этого значения в ту или другую сторону ферментативная активность снижается. Это объясняется изменением состояния активного центра фермента (уменьшением или увеличением ионизации функциональных групп), а также третичной структуры всей белковой молекулы, которая зависит от соотношения в ней катионных и анионных центров. Большинство ферментов имеют оптимум рН в области нейтральных значений. Однако есть ферменты, проявляющие максимальную активность при рН 1,5 (пепсин) или 9,5 (аргиназа). При работе с ферментами необходимо поддерживать рН с помощью соответствующего буферного раствора. Зависимость ферментативной активности от рН определяется значениями рК ионизированных групп белковой молекулы.
Активность ферментов подвержена значительным колебаниям в зависимости от воздействия ингибиторов (веществ, частично или полностью снижающих активность) и активаторов (веществ, увеличивающих активность). Их роль выполняют катионы металлов, некоторые анионы, переносчики фосфатных групп, восстановительных эквивалентов, специфические белки, промежуточные и конечные продукты метаболизма.
Принципы ферментативной кинетики. Суть кинетических исследований состоит в определении максимальной скорости ферментативной реакции Vmax и константы Михаэлиса Км. Ферментативная кинетика изучает скорости количественных превращений одних веществ в другие под действием ферментов. Скорость ферментативной реакции измеряют по убыли субстрата или приросту образующегося продукта за единицу времени либо по изменению концентрации одной из смежных форм кофермента.
Влияние концентрации фермента на скорость реакции выражается в следующем: если концентрация субстрата постоянна (при условии избытка субстрата), то скорость реакции пропорциональна концентрации фермента. Для кинетических исследований используют концентрацию фермента 10-8 М активных центров.
Оптимальное значение концентрации фермента определяют из графика зависимости активности фермента от его концентрации (рис.16).
Оптимальным считается значение, лежащее на плато полученного графика в области значений активности фермента, мало зависящих от его концентрации.
| V, µмоль/с |
| Сбелка, мг/мл |
Рис. 16. Зависимость скорости ферментативной реакции
от концентрации фермента
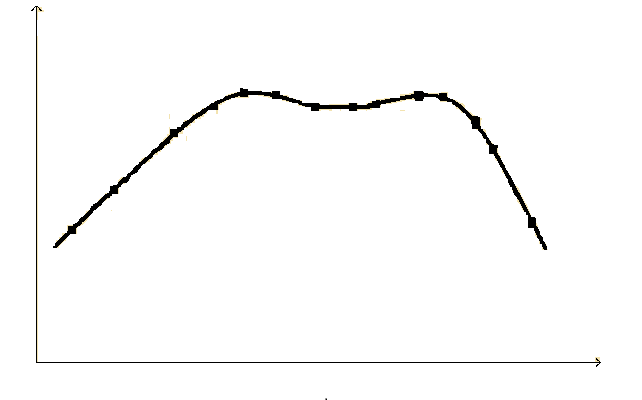
Для изучения влияния концентрации субстрата на скорость ферментативной реакции сначала строят кинетическую кривую, отражающую изменение концентрации субстрата S1 или продукта Р1 во времени и измеряют начальную скорость V1 реакции как тангенс угла наклона касательной к кривой в нулевой точке (рис. 17).
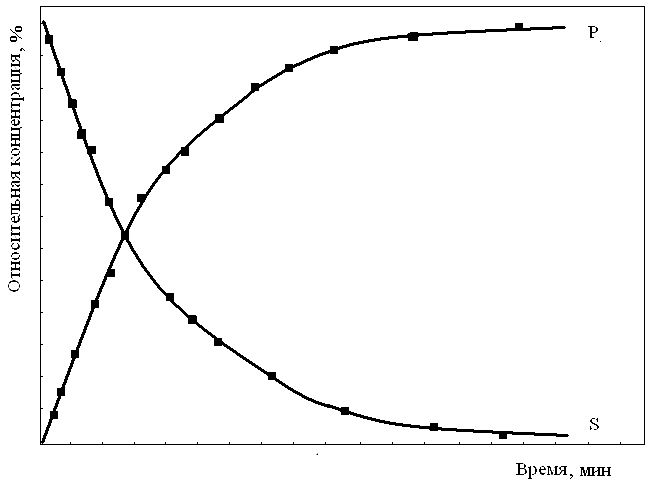
Рис. 17. Кинетические кривые ферментативной реакции
Построив кинетические кривые для других значений концентрации данного субстрата (S2, S3, S4 и т. д.) или продукта (Р2, Р3, Р4 и т. д.) и определив начальные скорости (V2, V3, V4 и т. д.) реакции, строят график зависимости начальной скорости ферментативной реакции от концентрации субстрата (при постоянной концентрации фермента), который имеет вид гиперболы (рис.17).
Кинетика многих ферментативных реакций описывается уравнением Михаэлиса - Ментен. При постоянной концентрации фермента и малых значениях концентрации субстрата S начальная скорость реакции прямо пропорциональна S. В этом случае говорят о полунасыщении фермента субстратом, когда половина молекул фермента находится в форме фермент-субстратного комплекса и скорость реакции V = 1/2Vmax. В отношении субстрата реакция имеет 1-й порядок (скорость реакции прямо пропорциональна концентрации одного реагирующего вещества) или 2-й (скорость реакции пропорциональна произведению концентраций двух реагирующих веществ).
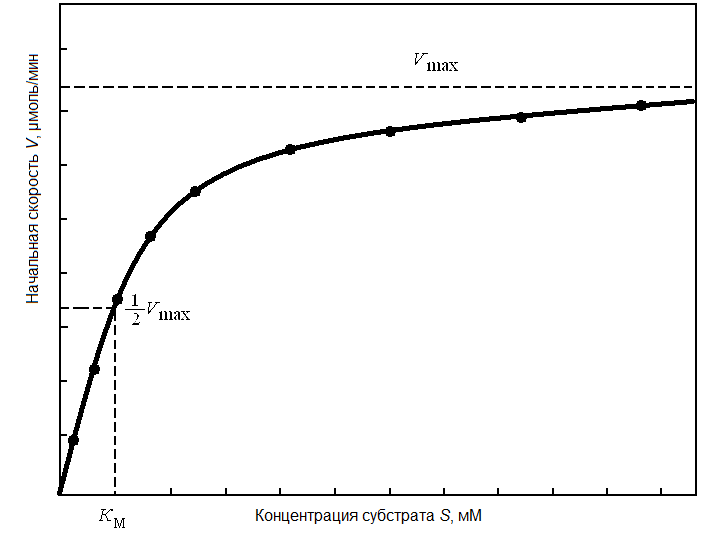
Рис. 18. Зависимость начальной скорости ферментативной реакции
от концентрации субстрата
При высоких значениях концентрации субстрата S скорость реакции почти не зависит от S – при дальнейшем увеличении S скорость реакции растет все медленнее и в итоге становится постоянной (максимальной). При этом достигается полное насыщение фермента субстратом, когда все молекулы фермента находятся в форме фермент-субстратного комплекса и V = Vmax. В отношении субстрата реакция имеет 0-й порядок (скорость реакции не зависит от концентрации реагирующих веществ).
В 1913 г. Л. Михаэлис и М. Ментен предложили простую модель, объясняющую такую кинетику. Согласно этой модели, образование специфического фермент-субстратного комплекса является необходимым промежуточным этапом катализа:
k1 k3
Е + S ⇄ ЕS → Е + Р
k2
Фермент Е соединяется с субстратом S, образуя ЕS-комплекс. Константа скорости этого процесса k1. Судьба ЕS-комплекса складывается двояко: он может либо диссоциировать на фермент Е и субстрат S с константой скорости k2, либо подвергнуться дальнейшему превращению, образуя продукт Р и свободный фермент Е с константой скорости k3. При этом постулируется, что продукт реакции не превращается в исходный субстрат. Это условие соблюдается на начальной стадии реакции, пока концентрация продукта невелика.
Скорость катализа определяют в стационарных условиях, когда концентрация промежуточных продуктов остается постоянной, тогда как концентрация исходных веществ и конечных продуктов изменяется. Это имеет место в том случае, когда скорость образования ЕS-комплекса равна скорости его распада.
Если ввести новую константу Км – константу Михаэлиса, моль/л, то:
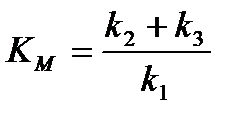 ,
,
Уравнение Михаэлиса – Ментен, выражающее количественное соотношение между скоростью ферментативной реакции и концентрацией субстрата, имеет вид:
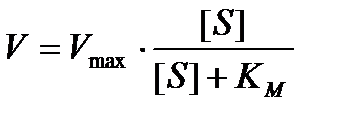 ,
,
Это уравнение соответствует графику зависимости скорости реакции от концентрации субстрата. При низких концентрациях субстрата, когда [S] намного ниже Км,
V = Vmax·[S] ∕ Км,
т. е. скорость реакции прямо пропорциональна концентрации субстрата. При высоких концентрациях субстрата, когда [S] намного выше Км,
V = Vmax,
т. е. скорость реакции максимальна и не зависит от концентрации субстрата. Если
[S] = Км, то V = Vmax ∕ 2.
Таким образом, Км равна концентрации субстрата, при которой скорость реакции составляет половину максимальной.
Константа Михаэлиса Км и максимальная скорость реакции Vmax – важные характеристики скорости при разных концентрациях субстрата. Vmax – величина постоянная для каждого фермента, которая позволяет оценить эффективность его действия.
Константа Михаэлиса показывает сродство субстрата к ферменту (в случае, когда k2 >> k3): чем меньше Км, тем больше сродство и выше скорость реакции, и наоборот. Каждый субстрат характеризуется своей величиной Км для данного фермента, и по их значениям можно судить о субстратной специфичности фермента. Константа Михаэлиса зависит от природы субстрата, температуры, рН, ионной силы раствора и наличия ингибиторов.
В связи с тем что определение Vmax и Км непосредственно из графической зависимости Михаэлиса – Ментен является неоднозначным, прибегают к линеаризации данного уравнения. Для этого его преобразуют в такую форму, чтобы графически оно выражалось прямой (рис. 19). Существует несколько методов линеаризации, среди которых наиболее часто применяют методы Лайнуивера – Бэрка и Эди – Хофсти.
Преобразование Лайнуивера – Бэрка имеет вид
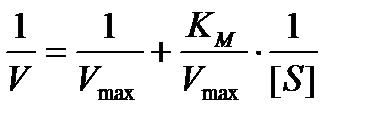
Строят график зависимости 1 / V = f (1 / [S]) и получают прямую линию, пересечение которой с осью ординат дает величину 1 / Vmax; отрезок, отсекаемый прямой на оси абсцисс – величину −1 / Км, а тангенс угла наклона прямой к оси абсцисс равен Км / Vmax. График позволяет более точно определять Vmax. Как будет видно ниже, из графика можно также извлечь ценную информацию, касающуюся ингибирования активности фермента.
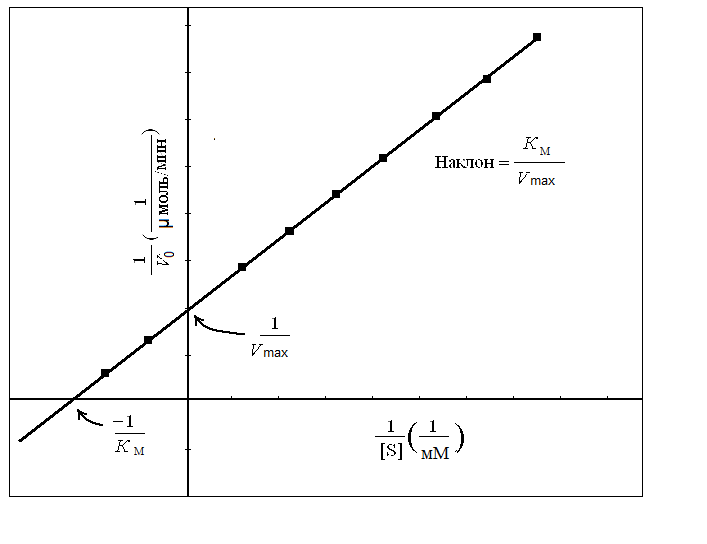
Рис. 19. Метод линеаризации уравнения Михаэлиса – Ментен
(по Лайнуиверу – Бэрку)
Метод Эди – Хофсти основан на преобразовании уравнения Михаэлиса – Ментен путем умножения обеих его частей на Vmax:
V = - Км · (V ∕ [S]) + Vmax.
График в координатах V и V/[S] представляет собой прямую линию, пересечение которой с осью ординат дает величину Vmax, а отрезок, отсекаемый прямой на оси абсцисс, – величину Vmax / Км (рис. 20). Он позволяет очень просто определять Км и Vmax, а также выявлять возможные отклонения от линейности, не обнаруживаемые на предыдущем графике.
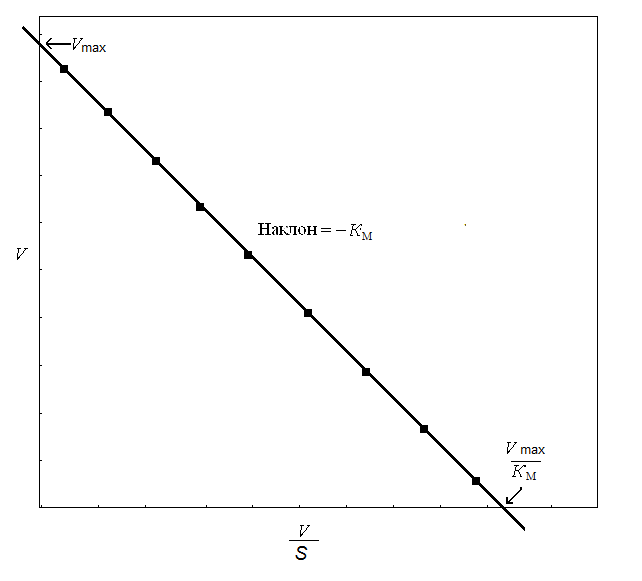
Рис. 20. Метод линеаризации уравнения Михаэлиса – Ментен
(по Эди – Хофсти)
Ингибирование активности ферментов.Действие ферментов можно полностью или частично подавить определенными химическими веществами – ингибиторами.
По характеру своего действия ингибиторы подразделяются на обратимые и необратимые. В основе такого деления лежит прочность связывания ингибитора с ферментом.
Обратимые ингибиторы – это соединения, которые нековалентно взаимодействуют с ферментом, при их удалении активность фермента восстанавливается. Обратимое ингибирование может быть конкурентным, неконкурентным и бесконкурентным.
Примером конкурентного ингибирования является действие структурных аналогов субстрата, которые могут связываться с активным центром фермента похожим способом, как и субстрат, не превращаясь, однако, в продукт и препятствуя взаимодействию фермента с истинным субстратом, т. е. имеет место конкуренция между субстратом и ингибитором за связывание с активным центром фермента. В результате образования комплексов фермент - ингибитор (EI) концентрация ES-комплексов уменьшается и, как следствие, падает скорость реакции. Иными словами, конкурентный ингибитор уменьшает скорость катализа путем снижения доли молекул фермента, связавших субстрат.
Измерение скоростей реакций при разных концентрациях субстрата позволяет отличать конкурентное ингибирование от неконкурентного. При конкурентном на графике зависимости 1 / V = f (1 / [S]) прямые пересекают ось ординат в одной точке 1 / Vmax независимо от присутствия ингибитора, но в присутствии ингибитора увеличивается тангенс угла наклона прямой к оси абсцисс, т. е. Vmax не изменяется, а Км увеличивается, что свидетельствует об уменьшении сродства субстрата к ферменту в присутствии ингибитора.
Следовательно, при достаточно высокой концентрации субстрата в условиях конкуренции за активный центр фермента, когда субстрат вытесняет ингибитор из активного центра, ингибирование может быть устранено, и скорость катализируемой реакции восстанавливается.
При этом уравнение Михаэлиса − Ментен имеет вид:
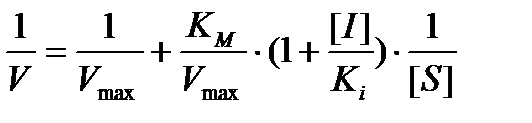 ,
,
где [I] – концентрация ингибитора;
Ki – константа ингибирования.
Константа ингибирования характеризует сродство фермента к ингибитору и представляет собой константу диссоциации ЕI-комплекса:
k1
Е + I ⇄ EI
k2
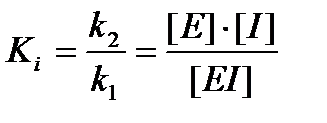 .
.
При неконкурентном ингибировании ингибитор отличается по структуре от субстрата и связывается не с активным, а с аллостерическим центром фермента. Это ведет к изменению конформации активного центра фермента, что сопровождается снижением каталитической активности фермента. Причем ингибитор может связываться не только со свободным ферментом (Е + I → EI), но и с фермент-субстратным комплексом (ES + I → ESI). Обе формы EI и ESI не активны. Субстрат и ингибитор могут быть одновременно связаны молекулой фермента, но участки их связывания не перекрываются. Действие неконкурентного ингибитора заключается в уменьшении числа оборотов фермента, а не в снижении доли связавших субстрат молекул фермента. Ингибитор не препятствует образованию ES-комплексов, но тормозит превращение субстрата в продукт.
Максимальная скорость реакции VmaxI в присутствии неконкурентного ингибитора описывается уравнением
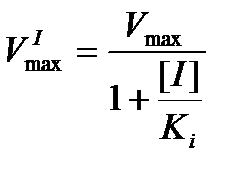
В частном случае бесконкурентного ингибирования, когда ингибитор связывается только с ES-комплексом и не связывается со свободным ферментом, на графике зависимости 1 / V = f (1 / [S]) прямые параллельны друг другу и пересекают оси ординат и абсцисс в разных точках.
Необратимые ингибиторы– это высокореакционноспособные соединения различной химической природы, которые могут взаимодействовать с функционально важными группами активного центра, образуя прочные ковалентные связи. Это приводит к безвозвратной потере активности фермента. В связи с этим теория Михаэлиса – Ментен, основанная на предположении, что присоединение ингибитора к ферменту носит обратимый характер, в данном случае неприменима.
Примером необратимого ингибирования служит взаимодействие ферментов с ионами тяжелых металлов, которые присоединяются к сульфгидрильным группам цистеиновых остатков фермента и образуют при этом меркаптиды – практически недиссоциирующие соединения, либо ковалентная модификация фермента под действием алкилирующих агентов.
Тема 6. Некоторые биологически важные белки
Гемоглобин представляет собой сложный белок, относящийся к группе гемопротеинов; белковый компонент в нем представлен глобином, небелковый – простетической группой. Простетическая группа в молекуле гемоглобина представлена четырьмя одинаковыми железопорфириновыми соедине-ниями, которые называются гемами. Молекула гема состоит из порфирина IХ, связанного с железом двумя атомами азота ковалентными связями, а двумя другими атомами азота координационными (рис. 21). Атом железа (II) расположен в центре гема и придает крови характерный красный цвет, степень его окисления не изменяется независимо от присоединения или отдачи кислорода.
Рис. 21. Структура гема
Гемоглобин выполняет две важные функции: перенос О2 из легких к периферическим тканям; участие в переносе СО2 и протонов из периферических тканей в легкие для последующего выведения из организма. В состав молекулы входят по две полипептидные цепи двух разных типов, каждая из которых оборачивает один гем гемоглобина. В крови взрослого человека содержится гемоглобин А (HbA), состоящий из a2b2 цепей.
Соединение гемоглобина с кислородом, образующееся в капиллярах легких, называется оксигемоглобином (HbO2). Он имеет ярко-алый цвет. Гемоглобин, отдавший кислород в капиллярах тканей, называется дезоксигемоглобином, или восстановленным (Hb). У него темно-вишневая окраска. От 10 до 30% углекислого газа, поступающего из тканей в кровь, соединяются с амидной группировкой гемоглобина. Образуется легкодиссоциирующее соединение карбгемоглобин (HbCO2). В этом виде часть углекислого газа транспортируется к легким. В некоторых случаях гемоглобин образует патологические соединения. При отравлении угарным газом образуется карбоксигемоглобин (HbCO). Сродство гемоглобина с окисью углерода значительно выше, чем с кислородом, а скорость диссоциации карбоксигемоглобина в 200 раз меньше, чем оксигемоглобина. На рис. 22 приведены спектры поглощения различных форм гемоглобина.
| ε×10 -4 |
Рис. 22. Спектры поглощения различных форм гемоглобина
Цитохромы (миогематины, гистогематины) – гемопротеиды, биологическая функция которых заключается в переносе электронов и осуществляется (в процессе тканевого дыхания) путем обратимого изменения валентности атомов железа, входящих в состав гема. В зависимости от конфигурации простетической группы цитохромы делятся на четыре типа (каждый из которых, в свою очередь, содержит несколько видов цитохромов): цитохромы a, b, c, d.
Цитохром P450(цитохром P450-зависимая монооксигеназа, англ. Cytochrome P450, CYP) – общее название ферментов семейства P450. Входят в класс гемопротеинов, относятся к цитохромам типа b. Цитохром P450, связанный с монооксидом углерода, имеет максимум поглощения света при длине волны 450 нм, что определило его название. У эукариотических организмов P450 являются мембранными белками. Cистема цитохрома P450 участвует в окислении многочисленных соединений, как эндогенных, так и экзогенных. Ферменты этой группы играют важную роль в обмене стероидов, желчных кислот, ненасыщенных жирных кислот, а также в нейтрализации ксенобиотиков (лекарств, ядов, наркотиков). Цитохром Р450-зависимые монооксигеназы катализируют расщепление различных веществ с участием донора электрона НАДФН и молекулярного кислорода. В этой реакции один атом кислорода присоединяется к субстрату, а второй восстанавливается до воды.
Ферменты семейства цитохрома P450, в отличие от остальных гемопротеинов, как правило, обладающих одним типом активности и строго определенной функцией, достаточно разнообразны по функциям, типам ферментативной активности, зачастую обладают малой субстратной специфичностью. P450 могут проявлять как монооксигеназную, так и оксигеназную активность, поэтому иногда относятся к оксидазам со смешанной функцией.
Оксигеназные реакции, катализируемые цитохромом Р450, весьма разнообразны. Одна из самых распространенных реакций окисления ксенобиотиков – окислительное деалкилирование, сопровождающееся окислением алкильной группы, присоединенной к атомам N, O или S. Другой распространенный тип реакций – гидроксилирование циклических соединений (ароматических, предельных и гетероциклических углеводородов). Ферменты семейства Р450 могут также катализировать реакции гидроксилирования алифатических соединений, N-окисление, окислительное дезаминирование, реакции восстановления нитросоединений. Механизм функционирования цитохрома Р450 представлен на рис. 23.
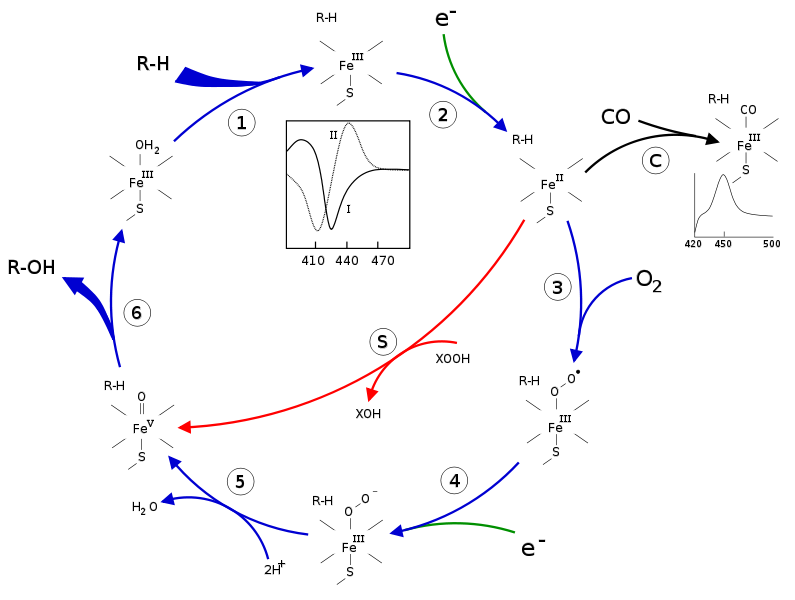
Рис. 23. Механизм функционирования цитохрома Р450
Цитохромы P450 катализируют омега-окисление насыщенных жирных кислот, перекисное окисление ненасыщенных жирных кислот, гидроксили-рование стероидных гормонов, желчных кислот и холестерина, биосинтез простагландинов.
Цитохромы P450 печени человека участвуют в нейтрализации ксенобиотиков (лекарств, ядов, наркотических веществ). Их субстратная специфичность невелика. Они наиболее эффективно катализирует окисление неполярных соединений с алифатическими или ароматическими кольцами. P450 печени, помимо прочего, участвует в окислении спиртов до соответствующих альдегидов. В связи с этим изучение ферментативной системы Р450 имеет большое значение для фармакологии.
Защитные белки – название в известной мере условное. В эту группу включены некоторые наиболее изученные белковые вещества, участвующие в проявлении защитных реакций организма. Основу их составляют белки иммунной системы (иммуноглобулины, антигены тканевой совместимости, интерлейкины, интерфероны и т. п.). В эту же группу могут быть включены и белки, вызывающие свертывание крови (фибриноген, фибрин, тромбин).
Иммунитет – это врожденная, наследуемая способность организма распознавать и обезвреживать чужеродный материал, поступивший извне или образовавшийся в результате патологического процесса. Иммунная система человека и животных (позвоночных) высокоспециализирована и достаточно сложна. По своей значимости она сравнима с нервной системой. Основными органами иммунной системы человека являются костный мозг, лимфатические узлы, селезенка и тимус (зобная железа), которые связаны в функционально единое целое системами лимфо- и кровообращения. Общий вес клеток иммунной системы человека около 1кг.
Иммуноглобулины Ig – это растворимые гликопротеины, присутствующие в сыворотке крови, тканевой жидкости или на клеточной мембране, которые распознают и связывают антигены. Иммуноглобулины синтезируются В-лимфоцитами (плазматическими клетками) в ответ на чужеродные вещества определенной структуры – антигены. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (например, запуск классической схемы активации комплемента и связывание с клетками) являются важнейшим фактором специфического гуморального иммунитета, состоят из двух легких и двух тяжелых цепей. У млекопитающих выделяют пять классов иммуноглобулинов – IgG, IgA, IgM, IgD, IgE, различающхся между собой по строению и аминокислотному составу тяжелых цепей.
Антитела являются относительно крупными (~150 кДа – IgG) гликопротеинами, имеющими сложное строение. Состоят из двух идентичных тяжелых цепей и из двух идентичных легких цепей. К тяжелым ковалентно присоединены олигосахариды. В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной (IgG, IgD, IgE, сывороточный IgA), так и в олигомерной формах (димер-секреторный IgA, пентамер – IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε- и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Классификация по тяжелым цепям. Существует пять классов (изотипов) иммуноглобулинов, различающихся:
– величиной;
– зарядом;
– последовательностью аминокислот;
– содержанием углеводных компонентов.
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа распознает и связывает антиген, а затем усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов.
IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70 - 75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер, обеспечивая тем самым иммунитет плода и новорожденного.
IgM представляет собой пентамер основной четырехцепочечной единицы, содержащей две μ- цепи. При этом каждый пентамер содержит одну копию полипептида с J-цепью (20 кДа), который синтезируется антителообразующей клеткой и ковалентно связывается между двумя соседними FC-фрагментами иммуноглобулина. Появляются при первичном иммунном ответе B-лимфоцитами на неизвестный антиген, составляют до 10% фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа). Содержат 10-12% углеводов. Образование IgM происходит еще в пре-B-лимфоцитах, в которых первично синтезируются из μ-цепи; синтез легких цепей в пре-B-клетках обеспечивает их связывание с μ-цепями, в результате образуются функционально активные IgM, которые встраиваются в поверхностные структуры плазматической мембраны, выполняя роль антиген распознающего рецептора; с этого момента клетки пре-B-лимфоцитов становятся зрелыми и способны участвовать в иммунном ответе.
IgA сывороточный IgA составляет 15 - 20% всей фракции иммуноглобулинов, при этом 80% молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например, в слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной систем). Содержит 10 - 12% углеводов, молекулярная масса 500 кДа.
IgD составляет менее 1% фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором с высоким содержанием связанных с белком углеводов для В-лимфоцитов, еще не представлявшихся антигену. Молекулярная масса 175 кДа.
IgE в свободном виде в плазме почти отсутствует. Способен осуществлять защитную функцию в организме от действия паразитарных инфекций, обуславливает многие аллергические реакции. Механизм действия IgE проявляется через связывание с высоким сродством с поверхностными структурами базофилов и тучных клеток, с последующим присоединением к ним антигена, вызывая дегрануляцию и выброс в кровь высокоактивных аминов (гистамина и серотонина – медиаторов воспаления).
Белки мышц и соединительных тканей.Волокна коллагена очень прочны, они входят в состав сухожилий, кожи, хрящей, кровеносных сосудов. Коллаген, составляющий около одной трети всех белков позвоночных, относится к фибриллярным белкам, образующим длинные нити – фибриллы. К таким белкам принадлежат также α-кератины волос и шерсти, фиброин шелка; основой их служат сплетенные вместе α-спиральные пептидные цепи. Коллагеновые нити образуются путем плотной укладки (четырьмя уступами) молекул тропоколлагена. Тропоколлаген – основная структурная единица коллагена, имеет молекулярную массу 285 000 и состоит из трех полипептидных цепей. Эти цепи находятся в особой, присущей лишь коллагену, конформации и образуют тройную спираль. Прочность коллагеновых волокон (нить сечением около 1 мм выдерживает нагрузку более 10 кг) во многом достигается за счет дополнительных ковалентных «сшивок» между молекулами тропоколлагена. Близким аналогом коллагена является эластин – белок эластичных волокон, содержащийся в стенках кровеносных сосудов, в связках, в тканях шеи у гусей и лебедей. Характерное свойство эластина –его способность растягиваться в несколько раз. В структурном отношении он аналогичен коллагену, однако имеет мало остатков НуРrо и совсем не содержит остатков HyLys.
Гормоны – это биологически активные регуляторы эндогенного происхождения, т. е. синтезируемые в организме, а не вносимые в него извне. Гормоны разносятся по организму кровью и действуют на клетки-мишени, удаленные от эндокринных органов. К белковым гормонам относятся такие важнейшие соединения, как инсулин, гормон роста (соматотропин), некоторые гормоны гипофиза – центральной железы внутренней секреции: тиротропин, гонадотропин, лютропин, липотропин. Еще один белковый гормон – паратгормон – синтезируется в паращитовидных железах.
Инсулин синтезируется в β-клетках поджелудочной железы, образующих так называемые островки Лангерганса. Первоначально он образуется в форме прегормона – одноцепочечного белка, состоящего из 109 остатков аминокислот. При отщеплении 23-членного сигнального пептида получается проинсулин, быстро расщепляемый специфическими ферментами, в результате чего образуется молекула инсулина, состоящая из двух полипептидных цепей, соединенных двумя дисульфидными связями. Цепь А содержит 21, а цепь В – 30 аминокислотных остатков. Инсулин стал первым белком, у которого была расшифрована полная первичная структура. Инсулин – также первый белок, полученный с помощью химического синтеза. В ходе получения инсулина были синтезированы раздельно две его цепи, а затем проведено замыкание дисульфидных мостиков.
Соматотропин (СТГ, гормон роста) – белковый гормон, вырабатываемый передней долей гипофиза, секреция которого регулируется факторами гипоталамуса. Соматостатин ингибирует секрецию СТГ, а стимулирует ее пока не идентифицированный рилизинг-фактор гипоталамуса. Соматотропин относится к группе анаболических гормонов. При введении его в организм животного с гипофизарной недостаточностью наблюдается усиление роста скелетных костей и других тканей, усиливается синтез белка и секреция молока.
Пролактин. В аденогипофизе образуется еще один белковый гормон, близкий по химическим и биологическим свойствам соматотропину, – пролактин, или лактогенный гормон. Он значительно эффективнее стимулирует лактацию, чем соматотропин, и помимо этого обладает широким спектром биологического действия. Пролактин влияет на рост органов и тканей животных, регулирует водный и солевой баланс, стимулирует развитие вторичных половых признаков. Секреция пролактина находится под контролем гипоталамических факторов, в частности, пока не охарактеризованного химически пролактин-рилизингингибирующего фактора. Секрецию пролактина стимулируют тиролиберин и другие факторы. Молекула пролактина (овцы) состоит из 198 аминокислот и содержит три дисульфидных мостика.
Тема 7. Структура нуклеиновых кислот
Нуклеиновые кислоты – высокомолекулярные гетерополимеры, играющие основную роль в сохранении и реализации генетической информации. Различают два типа нуклеиновых кислот (НК: дезоксирибонуклеиновые кислоты ДНК, которые обеспечивают сохранение информации, и рибонуклеиновые кислоты РНК, принимающие участие в процессах генной экспрессии и биосинтеза белка. Нуклеиновые кислоты построены из нуклеотидных звеньев, которые, в свою очередь, состоят из азотистого основания, углеводного остатка и фосфатной группы.
При мягком щелочном гидролизе нуклеиновые кислоты распадаются на мономеры – нуклеотиды. Нуклеотиды при нагревании до 145 оС с водным аммиаком теряют остаток фосфорной кислоты с образованием нуклеозидов, которые в условиях кислотного гидролиза распадаются на азотистые основания и сахара.
Азотистые основания – это ароматические гетероциклические соединения, производные пиримидина или пурина. Пять азотистых оснований являются основными структурными компонентами нуклеиновых кислот, общими для всей живой материи.
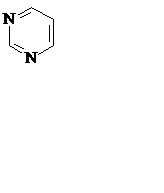
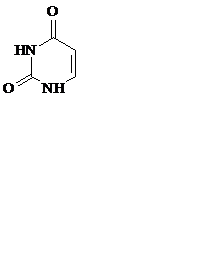
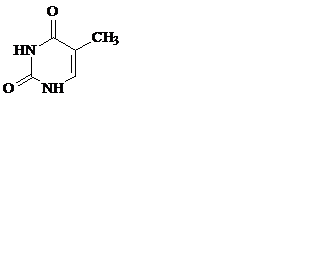
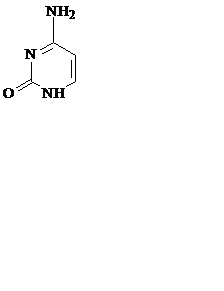
пиримидин урацил тимин цитозин
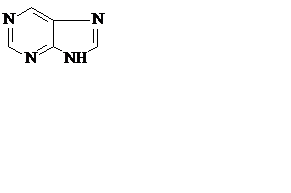
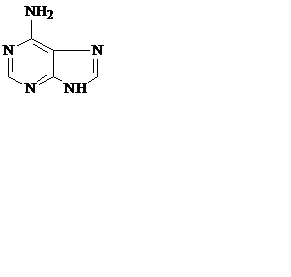
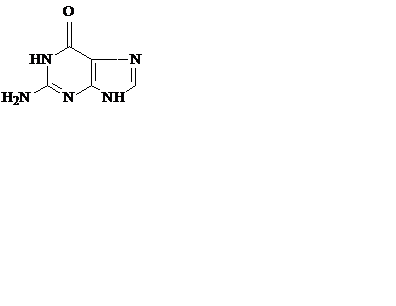
пурин аденин гуанин
В состав ДНК входят аденин, гуанин, тимин и цитозин. В состав РНК – аденин, гуанин, урацил и цитозин. Кроме перечисленных, в нуклеиновых кислотах в небольших количествах встречаются модифицированные азотистые основания, в основном метилированные и гидроксилированные, их называют минорными.
Для пуриновых и пиримидиновых оснований характерны лактам-лактимная и амин-иминная таутомерия. По данным ИК- и ЯМР-спектроскопии выявлено, что в нуклеиновых кислотах пуриновые и пиримидиновые основания преимущественно находятся в лактамной и аминной формах, это обеспечивает правильность спаривания.
Азотистые основания поглощают свет в УФ-области спектра с максимумом 260 нм, что используется для количественного определения НК.
Углеводная часть нуклеотидов, входящих в РНК, представлена рибозой, а входящих в ДНК, – дезоксирибозой. Пентозы в нуклеиновых кислотах всегда присутствуют в β-D-фуранозной форме. Углеводные атомы пентоз в нуклеотидах нумеруют со знаком «штрих», чтобы их можно было отличить от атомов азотистых оснований.
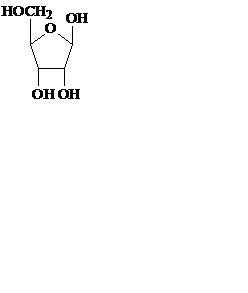
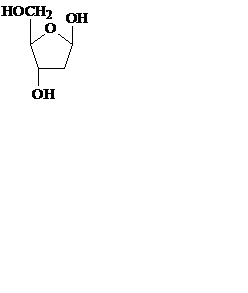
рибоза дезоксирибоза
Соединения азотистых оснований с пентозой с помощью N-гликозидных связей называют нуклеозидами – рибонуклеозидами (аденозин, гуанозин, цитидин и уридин) и дезоксирибонуклеозидами (дезоксиаденозин, дезоксигуанозин, дезоксицитидин и тимидин).
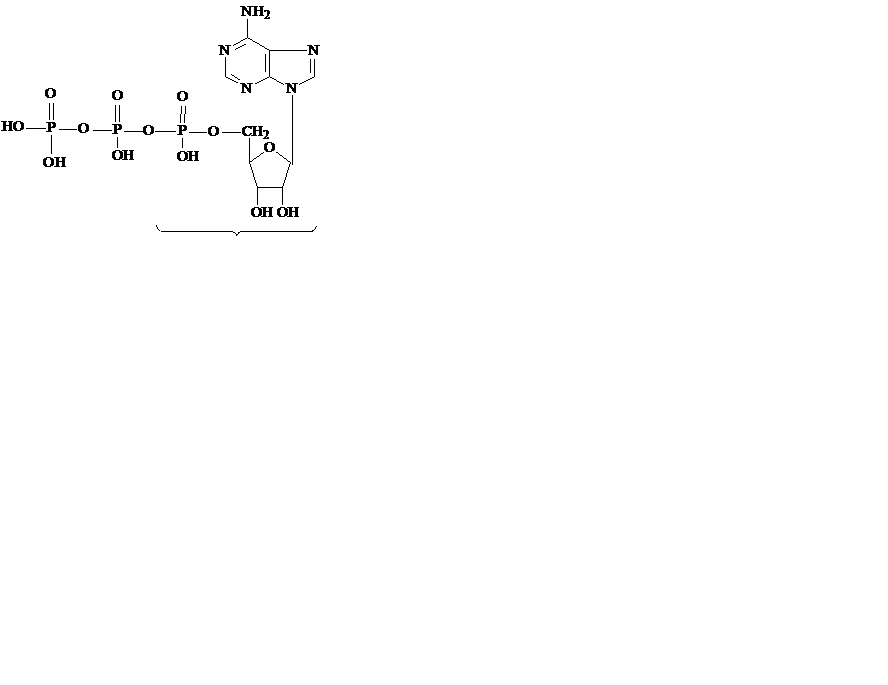
Нуклеозиды, этерифицированные фосфорной кислотой по 5’-положению, называются нуклеотидами. В случае одного остатка фосфорной кислоты они называются нуклеотидмонофосфатами, в случае двух остатков – нуклеотиддифосфатами, в случае трех – нуклеотидтрифосфатами (рис. 24).
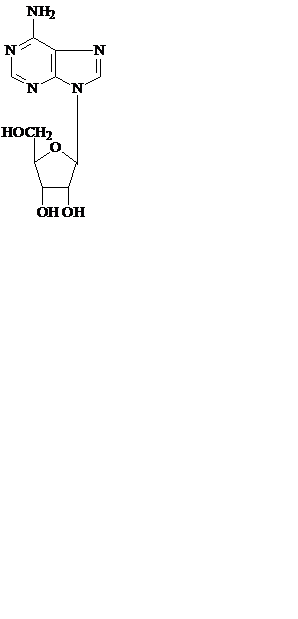
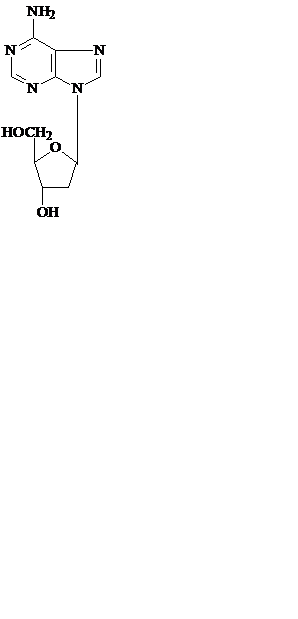
аденозин дезоксиаденозин
 аденозин-5’-монофосфат (АМФ)
аденозин-5’-монофосфат (АМФ)
 аденозин-5’-дифосфат (АДФ)
аденозин-5’-дифосфат (АДФ)
 аденозин-5’-трифосфат (АТФ)
аденозин-5’-трифосфат (АТФ)
Рис. 24. Структурные формулы нуклеотидфосфатов
В молекулах нуклеотидтрифосфатов остатки фосфорной кислоты соединены ангидридной связью, обладающей большой потенциальной энергией. Такие связи называются макроэргическими, а соединения – высокоэнергетическими. АТФ занимает центральную роль в обмене веществ и энергией во всех клетках, ГТФ энергетически обеспечивает процессы трансляции белков, УТФ необходим для синтеза гликогена, ЦТФ участвует в синтезе глицерофосфолипидов.
Нуклеиновые кислоты – это неразветвленные полимеры нуклеотидов, соединенных между собой 3’,5’-фосфодиэфирной связью. Полинуклеотиды, составленные из рибонуклеотидных звеньев, называются рибонуклеиновыми кислотами (РНК), из дезоксирибонуклеотидных звеньев – дезоксирибонуклеиновыми кислотами (ДНК).
Пример нуклеотида, построенного по типу РНК, представлен на рис. 25.
Ионизированные фосфатные группы полимерного остова сообщают молекулам нуклеиновых кислот большой отрицательный заряд. По этой причине в клетках ДНК обычно присутствуют в комплексе:
1) с основными белками – гистонами и протаминами;
2) поликатионами типа спермидина H2N–(CH2)4–NH–(CH2)3–NH2;
3) щелочноземельными катионами – Mg2+.
В РНК во 2-м положении рибозы имеются свободные гидроксильные группы, сильно влияющие на конформацию полимера. Отсутствие 2-ОН-группы в дезоксирибозе делает ДНК более устойчивой к щелочной деградации.
Как ДНК, так и РНК легко гидролизуются под действием кислот. Гликозидные связи в ДНК более лабильны, чем в РНК. Пуриновые нуклеотиды гидролизуются легче, чем пиримидиновые, и все же ковалентная структура этих молекул сравнительно устойчива, что определяет их способность служить генетическим материалом.
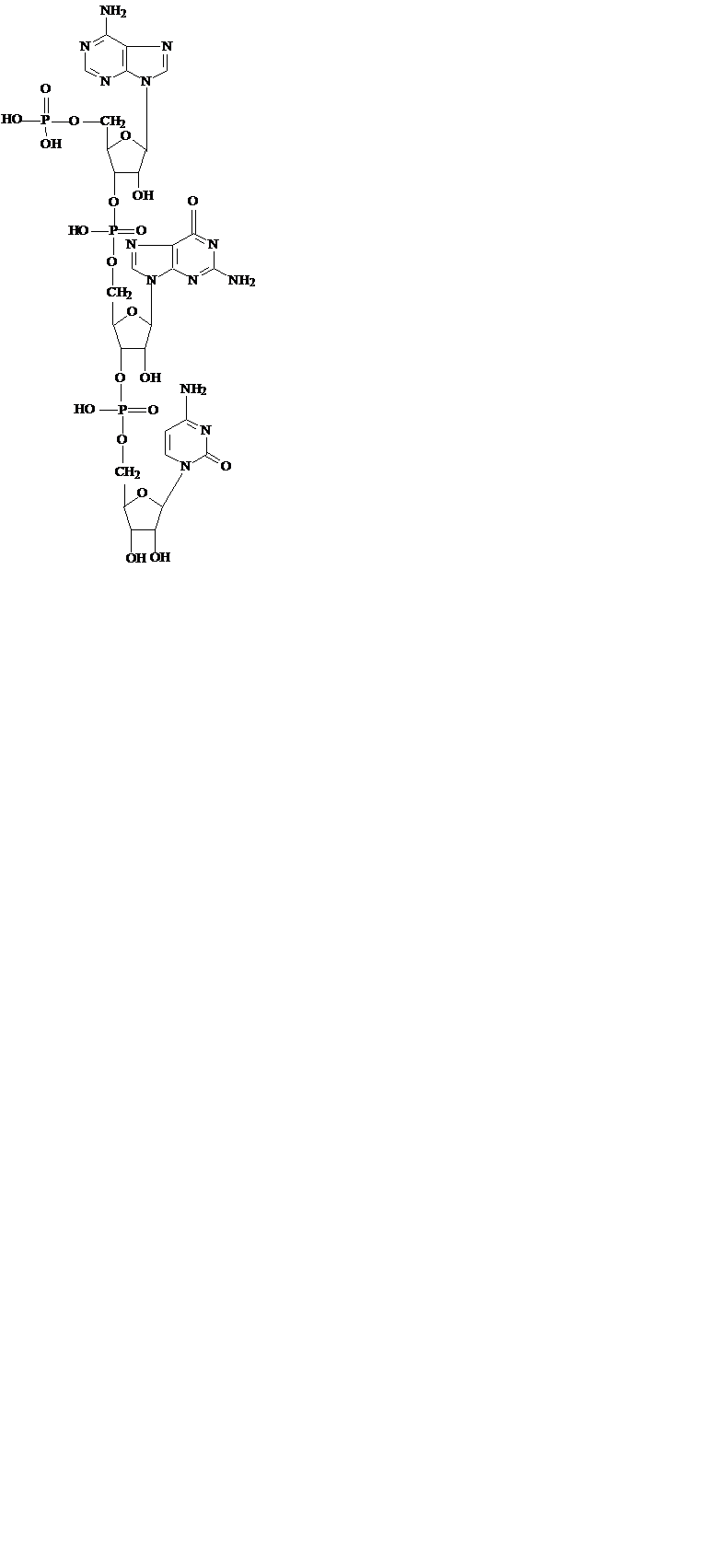
Рис. 25. Пример нуклеотида, построенного по типу РНК
Однако как ДНК, так и РНК вступают во множество химических реакций по азотистым основаниям:
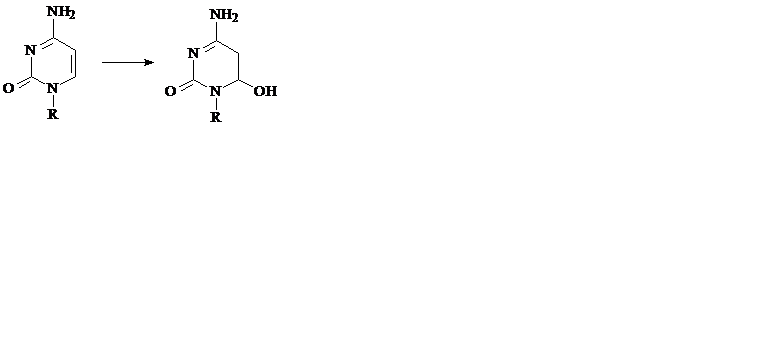
а) азотистая кислота реагирует с аминогруппами оснований, превращая их в гидроксильные группы, которые подвергаются таутомеризации и превращаются в кетогруппы. Таким образом, азотистая кислота превращает цитозин в урацил, аденин – в гипоксантин, гуанин – в ксантин и, следовательно, является эффективным химическим мутагеном (рис. 26):
Рис. 26. Превращение азотистых оснований под действием азотной кислоты.
б) другое мутагенное соединение, гидроксиламин (H2N–OH), реагирует с карбонильными группами, особенно в пиримидинах, даже несмотря на то, что эти карбонильные группы являются частью циклической амидной структуры и поэтому имеют сравнительно низкую реакционную способность:
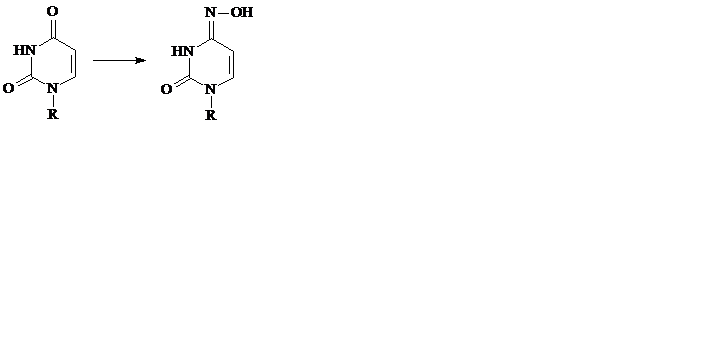
в) пиримидины легко восстанавливаются боргидридом натрия NaBH4:
г) уридин, тимидин и, в меньшей степени, цитозин в составе нуклеиновых кислот димеризуются при УФ-облучении; цитозин под действием УФ-света легко гидратируется:
д) формальдегид вступает в реакцию с аминогруппами пуриновых и пиримидиновых оснований:
Биологической ролью ДНК является хранение информации о белках, необходимых для жизни клетки, и передача этой информации дочерним клеткам.
Структурная организация ДНК достаточно сложна и имеет три уровня.
Первичная структура ДНК – это линейная цепь четырех видов дезоксирибонуклеотидов, соединенных фосфодиэфирной связью.
Вторичная структура ДНК – это двухцепочечная правозакрученная спираль из комплементарных друг другу антипараллельных полинуклеотидных нитей. Модель была предложена в 1953 г. Уотсоном и Криком.
Свойство комплементарности было выведено на основании некоторых закономерностей, отмеченных Чаргаффом, а именно:
– в каждом типе ДНК количество аденина примерно равно количеству тимина, а количество гуанина – количеству цитозина;
– сумма пуриновых оснований равна сумме пиримидиновых;
– напротив, соотношение аденин + тимин/гуанин + цитозин в различных организмах неодинаково.
Было установлено, что АТ-тип ДНК преобладает в животных и растительных клетках, а ГЦ-тип – в микроорганизмах. Сравнение организмов по их ГЦ-содержанию иногда используют как основу для установления филогенетического родства. Нужно, однако, учесть, что тимин под действием УФ-света претерпевает ряд фотохимических превращений, поэтому бактерии с высоким ГЦ-содержанием могут чаще встречаться там, где много солнечного света, тогда как более низкое ГЦ-содержание может указывать на то, что местообитанием данного организма являются более защищенные от солнца места.
Модель Уотсона и Крика позволила объяснить причину этих закономерностей – каждое основание одной цепи связано с комплементарным ему основанием другой цепи водородными мостиками. При этом аденин комплементарен тимину, а гуанин – цитозину. Таким образом, каждая пара состоит из одного пуринового и одного пиримидинового основания, причем пары комплементарных оснований близки и по размеру, и по форме. Пара А–Т может образовывать два, а пара Г–Ц – даже три водородных мостика.
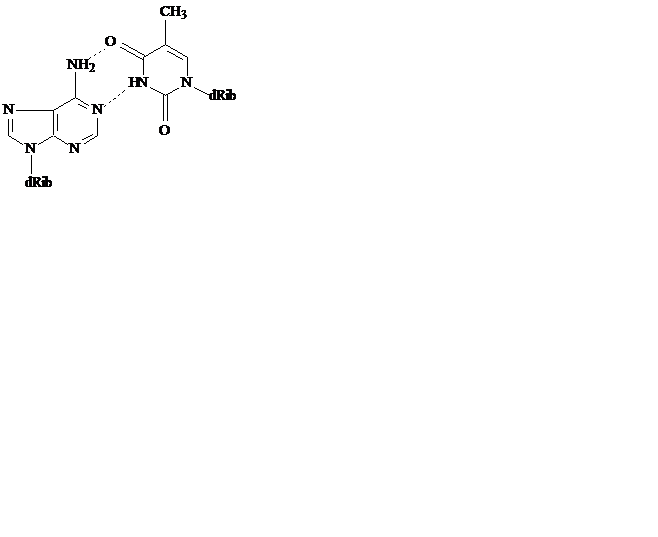
Благодаря способности азотистых оснований к спариванию, образуется хорошо стабилизированная двухцепочечная структура, где пары оснований расположены внутри двойной спирали и образуют неполярную область ДНК. Гидрофобные взаимодействия между ароматическими основаниями стабилизируют структуру, преодолевая силы электростатического отталкивания между отрицательно заряженными фосфатными группами. Остатки дезоксирибозы двух антипараллельных цепей образуют правозакрученную спираль, где на каждый виток приходится 10 пар оснований. Внешняя сторона спирали заряжена отрицательно за счет фосфатных групп. В спирали существуют две бороздки – большая и маленькая.
На основании рентгеноструктурного анализа было установлено, что двойная спираль ДНК кроме описанной выше формы В, благоприятной для репликации, может существовать в некоторых других формах: форме А, благоприятной для процессов транскрипции, форме Z, участвующей в регуляции экспрессии генов, форме С, выявленной у ряда вирусов. Все эти формы различаются диаметром, числом пар оснований в витке, углом наклона плоскости оснований по отношению к оси молекулы и способны взаимно переходить друг в друга в зависимости от условий среды.
В функциональном отношении две цепи ДНК неэквивалентны. Кодирующей цепью является та из них, которая считывается в процессе транскрипции. Именно эта цепь служит матрицей для РНК. Некодирующая цепь по последовательности подобна РНК при условии замены тимина на урацил. Общепринято давать структуру гена в виде последовательности некодирующей цепи ДНК в направлении 5’→3’. Если прочитать кодоны в этом направлении, то с помощью генетического кода можно воспроизвести аминокислотную последовательность белка в принятом порядке, от N- к С-концу.
Третичная структура ДНК – более плотная упаковка с образованием сложных трехмерных структур. Прокариоты имеют кольцевую ДНК, закрученную в левую суперспираль. Эукариоты также образуют суперспираль, но не свободной ДНК, а ее комплексов с белками хромосом.
Дезоксирибонуклеопротеиды – комплексы ДНК с белками хромосом – составляют хроматин. Хроматин можно видеть в оптический микроскоп только во время деления клеток, когда он находится в конденсированном виде в составе хромосом. Гистоны формируют первичную степень компактизации хроматина – так называемые нуклеосомы. По две молекулы каждого из гистонов Н2а, Н2б, Н3, Н4 составляют октамер (кор), обвитый 1,8 витками спирали ДНК поверх белковой структуры. Участок ДНК (линкерная ДНК), непосредственно не связанный с гистоновым кором, взаимодействует с гистоном Н1. Этот белок обеспечивает формирование вторичной суперспиральной структуры ДНК – нуклеомеры. Когда хроматин конденсируется далее за счет тех же Н1 как скрепок, формируются петли – так называемая структура «ламповых щеток». Примерно 20 петель образуют минидиски – хромонемы. Большое число минидисков укладывается в стопку, составляя хромосому. Гистоны в октамере имеют подвижный N-конец из 20 аминокислот, который выступает из нуклеосомы и важен для поддержания структуры хроматина и контроля за генной экспрессией. Так, конденсация хромосом связана с фосфорилированием гистонов, а усиление транскрипции – с ацилированием в них остатков лизина. В хроматин входит также группа негистоновых белков. Она высоко гетерогенна и включает структурные ядерные белки, множество ферментов и факторов транскрипции, связанных с отдельными участками ДНК и осуществляющих регуляцию генной экспрессии и других процессов.
РНК принимают участие во всех стадиях процесса генной экспрессии и биосинтеза белка. Различают три основных вида РНК: рибосомальная, транспортная и матричная (информационная). РНК клетки существенно различаются по размерам и продолжительности существования, по вторичной и третичной структуре. Из-за стерических ограничений, вызванных ОН-группой во 2’-положении рибозы, РНК не могут образовывать структуры, подобные двойной спирали, и имеют менее регулярную вторичную структуру.
мРНК – короткоживущие и наиболее гетерогенные РНК. Они являются копиями определенных участков ДНК, в которых заключена информация о последовательности аминокислот в кодируемых ими белках. После синтеза мРНК транспортируются к рибосомам – белоксинтезирующим машинам клетки, где на их основе синтезируется необходимый клетке белок. В целом, в линейной молекуле мРНК формируется несколько двуспиральных шпилек, на концах которых располагаются знаки инициации и терминации трансляции.
Транспортные РНК, активирующие аминокислоты и переносящие их к рибосомам, являются небольшими долгоживущими молекулами. Они содержат 70 - 90 нуклеотидов, которые с помощью своих антикодонов узнают за счет спаривания оснований определенные кодоны на мРНК. На 3’-конце всех тРНК, называемом акцепторным, обязательным является тринуклеотид ЦЦА, за счет которого и присоединяется определенная аминокислота. Каждой из 20 аминокислот соответствует своя тРНК. Для некоторых аминокислот, кодируемых двумя или более кодонами, существует несколько тРНК. В молекуле тРНК содержится довольно много минорных и модифицированных оснований – псевдоуридин, дигидроуридин, тимидин, встречающийся обычно в ДНК, а также много метилированных нуклеотидов, таких как 7-метилгуанидин. Конформацию молекулы стабилизируют многочисленные пары оснований, часть из которых не соответствует общим принципам спаривания оснований. Пространственное изображение вторичных структур всех тРНК имеет форму клеверного листа. В «клеверном листе» кроме акцепторного участка различают три обязательные петли:
а) антикодоновая содержит антикодон, представляющий собой специфический триплет нуклеотидов, который комплементарен в антипараллельном направлении кодону мРНК, кодирующему соответствующую аминокислоту;
б) псевдоуридиловая обеспечивает взаимодействие с рибосомами;
в) дигидроуридиловая обеспечивает взаимодействие тРНК с соответствующей аминоацил-тРНК-синтетазой.
Третичная структура тРНК очень компактна и чаще всего описывается термином «локтевой сгиб». Третичные структуры всех тРНК настолько похожи, что смесь различных тРНК образует кристаллы.
Самой длинной и долгоживущей является рибосомальная РНК, выполняющая роль структурного компонента рибосом. Число рибосом в клетке очень велико. Вторичная структура рРНК образуется за счет коротких двуспиральных участков молекулы – шпилек, чередующихся с одноцепочечными участками, к которым присоединяются белки. Третичная структура рРНК – образование в комплексе с рибосомальными белками малой и большой субъединицы рибосом.
Нуклеиновые кислоты могут денатурировать. Этот процесс состоит в расхождении цепей двойной спирали ДНК и двуспиральных участков молекулы РНК. Денатурацию можно вызвать нагреванием, добавлением кислоты, щелочи, спиртов, мочевины или удалением стабилизирующих структуру молекулы противоионов, например Mg2+. В результате денатурации каждая из цепей молекулы приобретает форму беспорядочно свернутого клубка. Денатурация ДНК сопровождается усилением оптического поглощения в УФ-области пуриновых и пиримидиновых оснований. Это явление называют гиперхромным эффектом. В нативном состоянии нуклеиновые кислоты поглощают свет менее интенсивно, чем в денатурированном. Этот так называемый гипохромный эффект обусловлен гидрофобными взаимодействиями между основаниями, плотно уложенными в стопку в структуре нативной молекулы. Тепловая денатурация нуклеиновых кислот происходит в довольно узком интервале температур. Характерным параметром процесса является температура плавления. Температурная зависимость поглощения УФ-света при 260 нм называется кривой плавления. Температура плавления Тпл – это точка, при которой прирост поглощения составляет половину максимального. Чем выше ГЦ-содержание нуклеиновой кислоты, тем более устойчива она к денатурации, причем зависимость Тпл от ГЦ-содержания почти линейна. Точное соотношение между ГЦ-содержанием ДНК и Тпл очень сильно зависит от ионного состава и рН среды. Полная денатурация молекулы ДНК приводит к расхождению комплементарных цепей. При быстром охлаждении раствора денатурированной ДНК цепи остаются в разделенном состоянии. Однако если в течение какого-то времени поддерживать температуру чуть ниже температуры плавления (этот процесс называют отжигом), может вновь восстановиться нативная структура. Этот факт дает в руки ученым очень важный метод исследования нуклеиновых кислот, основанный на образовании гибридов.
Одним из типов двойных спиралей, которые получают искусственным путем, является гибрид ДНК-РНК. Оказалось, что молекулы мРНК гибридизируются с одной из двух разделившихся цепей ДНК, несущей участки, комплементарные мРНК. Метод гибридизации используется также для получения гетеродуплексов ДНК, в которых две цепи молекулы происходят от двух разных генетических линий одного и того же вида организмов. Известно, что некоторые мутации состоят в выпадении или вставке одного или нескольких оснований в цепь ДНК. Гетеродуплексы, в которых одна из цепей нативная, а другая – со вставкой или делецией, имеют по всей своей длине нормальную структуру по Уотсону–Крику, за исключением тех участков, где делеции или вставки нарушают комплементарность и образуются одноцепочечные петли.
Опыты по гибридизации позволили исследовать гомологичность нуклеиновых кислот из разных источников. Вначале молекулы расщепляют с помощью ультразвука на фрагменты длиной около 1000 нуклеотидов и подвергают денатурации. Фрагменты денатурированной ДНК смешивают с денатурированной ДНК из другого источника. Участки ДНК разных видов, имеющие близкие нуклеотидные последовательности, в той или иной степени гибридизуются, тогда как участки с сильно различающимися последовательностями гибридизации не поддаются.
Тема 8. Строение углеводов и углеводсодержащих биополимеров
Моносахариды, их олигомеры (олигосахариды) и полимеры (полисахариды) составляют класс углеводов.
Моносахариды (глюкоза, фруктоза, рибоза) представляют собой альдегиды или кетоны, содержащие две или более ОН-группы, общей формулой (СН2О)n. Кроме гидроксильных и карбонильных групп они могут содержать тиольные, карбоксильные, аминогруппы и др.
Полисахариды (целлюлоза, крахмал, гликонен, хитин) являются продуктами поликонденсации моносахаридов. Полисахариды, построенные из остатков одного и того же моносахарида, называются гомополисахаридами, а полисахариды, содержащие остатки различных моносахаридов, − гетерополисахаридами.
Олигосахариды (сахароза, лактоза) составляют промежуточную группу между моно- и полисахаридами и содержат от 2-х до 10 моносахаридных остатков.
Биологические функции углеводов:
1) энергетическая – углеводы служат источником энергии для организма. При окислении 1 г углеводов выделяется 17,6 кДж (4,2 ккал) энергии. Следует отметить, что сахара являются главным источником быстро мобилизуемой энергии, так как в процессе пищеварения они легко переводятся в форму, пригодную для удовлетворения энергетических потребностей клеток;
2) строительная – целлюлоза входит в состав клеточных стенок растений, хитин обнаруживается в клеточной стенке грибов и в наружном скелете членистоногих, гликопротеиды – соединения углеводов с белками – входят в состав хрящевой и костной ткани животных;
3) запасающая – выражается в том, что крахмал накапливается клетками растений, а гликоген – клетками животных. Эти вещества служат для клеток и организмов источником глюкозы, которая легко высвобождается по мере необходимости;
4) защитная – гепарин – ингибитор свертывания крови; слизи, выделяемые различными железами и богатые углеводами, предохраняют пищевод, кишечник, желудок, бронхи от механических повреждений, препятствуют проникновению в организм бактерий и вирусов; камеди, выделяющиеся в местах повреждения стволов и ветвей, защищают деревья и кустарники от проникновения инфекций через раны;
5) составная часть жизненно важных веществ – входят вместе с белками в состав ферментов, входят в состав ДНК, РНК, АТФ, участвуют в синтезе коферментов НАД+, НАДФ+, ФАД+.
Простейшие из моносахаридов (n = 3) называются триозами. К ним относятся глицеральдегид и дигидроксиацетон. Глицеральдегид назван альдозой, так как он содержит альдегидную группу, а дигидроксиацетон – кетозой, поскольку в его состав входит кетогруппа.
Моносахариды с четырьмя, пятью и шестью атомами углерода называются соответственно тетрозами, пентозами и гексозами. Так, из гексозных сахаров D-глюкоза является альдозой, а D-фруктоза – кетозой.
Природные моносахариды обладают оптической активностью, причем величина удельного вращения является характерным параметром моносахарида. Все моносахариды, за исключением дигидроксиацетона, содержат один или более асимметрических атома углерода. Простейшей альдозой, имеющей один асимметрический атом углерода, является глицеральдегид, существующий в двух стереоизомерных формах – D- и L-изомеров.
Моносахариды, содержащие два и более асимметрических атома углерода, относятся к D- или L-ряду в зависимости от конфигурации асимметрического атома углерода, наиболее удаленного от альдегидной или кетогруппы. Моносахарид (изображенный в проекциях Фишера) относят к D-ряду, если ОН-группа асимметрического атома углерода, наиболее удаленного от альдегидной или кетогруппы, находится справа, а атом водорода – слева, как в D-глицеральдегиде. Если ОН-группа асимметрического атома углерода, наиболее удаленного от альдегидной или кетогруппы, находится слева, а атом водорода – справа, как в L-глицеральдегиде, моносахарид относят к L-ряду.
Простейшей кетозой, имеющей один асимметрический атом углерода, является тетроза – тетрулоза.
Два моносахарида, отличающиеся только по конфигурации одного определенного атома углерода, называются эпимерами. Например, D-глюкоза и D-манноза являются эпимерами по второму углеродному атому, а D-глюкоза и D-галактоза – эпимерами по четвертому углеродному атому.
Ниже изображены альдозы D-ряда, родоначальником которых является D-глицериновый альдегид (рис. 27).
Рис. 27. Альдозы D-ряда
На рис.28 изображены кетозы D-ряда.
Рис. 28. Кетозы D-ряда
Приведенные выше структуры моносахаридов являются ациклическими. Однако моносахариды могут образовывать циклические структуры в результате взаимодействия карбонильной группы моносахарида с одной из его гидроксильных групп. Альдегидная группа обладает высокой реакционной способностью и может реагировать с -ОН-группой с образованием циклического полуацеталя. Так, альдегидная группа при С1 атоме в молекуле глюкозы с открытой цепью реагирует с -ОН-группой при С5 атоме этой же молекулы, образуя внутримолекулярный полуацеталь (рис. 29). Образованный таким образом 6-членный циклический сахар называется пиранозой из-за его сходства с пираном.
Рис. 29. Образование полуацеталей у альдоз
Подобно этому кетогруппа может реагировать с -ОН-группой с образованием циклического полукеталя (рис. 30). Так, кетогруппа при С2 атоме фруктозы с открытой цепью взаимодействует с -ОН-группой при С5 атоме с образованием внутримолекулярного полукеталя. Этот 5-членный циклический сахар называется фуранозой из-за его сходства с фураном. У альдоз фуранозный цикл образуется с участием ОН-группы при С4 атоме.
Рис. 30. Образование полуацеталей у кетоз
При циклизации альдоз и кетоз возникает новый хиральный центр при С1 и С2 атомах, ранее входивших в состав альдегидной и кетогруппы соответственно. Это влечет за собой появление еще одной пары стереоизомеров (аномеров) для каждого моносахарида, которые отличаются друг от друга по конфигурации С1 (С2 у кетоз) карбонильного атома и называются a- иb-изомерами (аномерами).Символ a означает, что -ОН-группа при С1 (С2 у кетоз) атоме расположена под плоскостью кольца, а символ b означает, что эта -ОН-группа находится над плоскостью кольца. С1 (С2 у кетоз) атом, находящийся в центре полуацетальной группы и непосредственно связанный с двумя атомами кислорода, называется аномерным углеродным атомом, а гидроксил, образующийся при С1 (С2 у кетоз) атоме в результате циклизации моносахарида, называется полуацетальным. Он резко отличается по свойствам от других -ОН-групп молекулы и легко может замещаться на другие нуклеофильные группы с образованием различных производных моносахаридов. Циклические формы моносахаридов принято изображать в формулах Хеуорса, так как проекционные формулы Фишера дают весьма смутное представление о трехмерной структуре моносахаридов. Нижнюю часть кольца (жирные линии) представляют выступающей к наблюдателю, а противоположный край – лежащим за плоскостью рисунка. Примерная плоскость кольца перпендикулярна плоскости бумаги. Эти формулы однозначно указывают конфигурацию молекулы, но не отображают взаимного пространственного расположения групп, присоединенных к кольцу. Поэтому для изображения пространственной структуры моносахаридов применяются конформационные формулы:
a-D-глюкоза b-D-глюкоза
Дата добавления: 2015-12-22; просмотров: 11469;
