Вычисление рН раствора
Вычислить рН и рОН раствора, если 


pH=3,3, pOH=10,7
Гидролиз
Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. (hydor – вода, lysis – разложение).
Существуют четыре случая гидролизационных соединений:
1) в реакцию гидролиза вступают соли, образованные слабой кислотой и слабым основанием.

Гидролиз протекает глубоко до образования слабой уксусной кислоты и слабого основания гидроксида аммония. рН среды в этом случае будет нейтральная.
2) гидролиз соли, образованной слабым основанием и сильной кислотой.
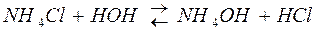
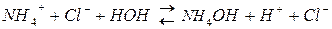
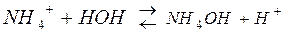 ,
, 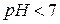
Соль имеет кислую реакцию, так как накапливаются Н+.
3) гидролиз соли, образованной сильным основанием и слабой кислотой.
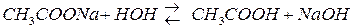

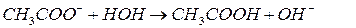 ,
, 
гидролиз идет с накоплением ионов ОН– и имеет щелочную среду.
4) гидролизу соли, образованные сильным основанием и сильной кислотой не подвергаются, т.к. гидролиз сводится к следующему:
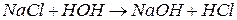
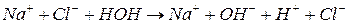

При гидролизе устанавливается равновесие в растворе между солью и образующимися кислотой и основанием. Доля вещества, подвергающаяся гидролизу называется степенью гидролиза. Зависит от константы равновесия, от t˚ и от концентрации соли.
Перепишем: 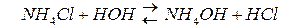
Этому равновесию отвечает константа:
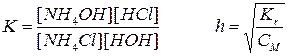
Концентрация воды в разбавленных растворах представляет собою постоянную величину.
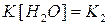
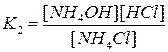
Величина  называется константой гидролиза соли. Её значение характеризует способность данной соли подвергаться гидролизу. Чем она больше, тем большему гидролизу подвергается соль. Чем слабее кислота или основание, тем в большей степени подвергаются гидролизу её соли.
называется константой гидролиза соли. Её значение характеризует способность данной соли подвергаться гидролизу. Чем она больше, тем большему гидролизу подвергается соль. Чем слабее кислота или основание, тем в большей степени подвергаются гидролизу её соли.
Гидролиз как и диссоциация протекает ступенчато, если кислота многоосновна или если гидроксид имеет несколько гидроксогрупп.

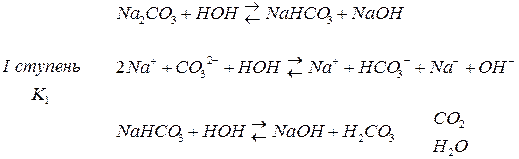
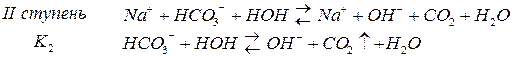
 По первой ступени гидролиз всегда полнее.
По первой ступени гидролиз всегда полнее.
Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что с разбавлением раствора степень гидролиза увеличивается.
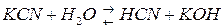
ему отвечает константа:
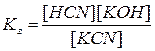
Разбавим в 10 раз раствор. Концентрации 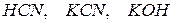 уменьшатся в 10 раз. Числитель уменьшится в 100 раз, а знаменатель в 10 раз. Но константа не зависит от концентрации веществ, поэтому равновесие в растворе нарушится. Чтобы равновесие установилось, числитель должен возрасти, а знаменатель уменьшится, т.е. количество соли должно гидролизоваться, концентрации
уменьшатся в 10 раз. Числитель уменьшится в 100 раз, а знаменатель в 10 раз. Но константа не зависит от концентрации веществ, поэтому равновесие в растворе нарушится. Чтобы равновесие установилось, числитель должен возрасти, а знаменатель уменьшится, т.е. количество соли должно гидролизоваться, концентрации 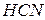 и
и 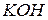 возрастут, а концентрация
возрастут, а концентрация 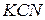 уменьшится. Таким образом, степень гидролиза соли увеличиться.
уменьшится. Таким образом, степень гидролиза соли увеличиться.
Влияние t˚ на степень гидролиза вытекает из принципа Ле – Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением. Выход эндотермических реакций с ростом t˚ растёт, поэтому с повышением t˚ степень гидролиз увеличивается.
Чтобы соли не подвергались гидролизу, нужно хранить при низких t˚ и концентрированными. Кроме того, подавлению гидролизу способствует подкисление солей ( 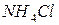 ), образованных сильной кислотой и слабым основанием или подщелачивание солей образованных сильным основанием и слабой кислотой.
), образованных сильной кислотой и слабым основанием или подщелачивание солей образованных сильным основанием и слабой кислотой.
Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы, или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо; т.е. с полным разложением соли.
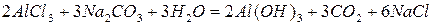

По протонной теории кислот и оснований протон переходит при гидролизе от молекулы воды к данному иону или от данного иона к молекуле воды.
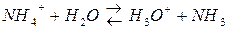
Дата добавления: 2015-12-22; просмотров: 1028;
