Методы изучения структуры нуклеиновых кислот
В течение ряда лет о первичной структуре нуклеиновых кислот судили по косвенным данным (оценивали количество пуриновых и пиримидиновых оснований, распределение минорных оснований, особенности физических свойств). Усовершенствование метода электрофореза в полиакриламидном геле и открытие рестриктаз позволило перейти на качественно другой уровень исследований в данной области. Рестриктазы применяются для разрезания нуклеиновых кислот на фрагменты, причем разделение происходит в строго определенных точках. Полученные фрагменты разделяют методом электрофореза, затем исследуют их нуклеотидную последовательность. Для секвенирования (определения последовательности мономеров) применяют методы Максама-Гилберта или Сэнгера.
ГЛАВА 6
БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ
Способность к передаче наследственных свойств путем переноса генетической информации является уникальным свойством живых систем. В организмах существуют три варианта передачи генетической информации.
1. Репликация -перенос генетической информации в пределах одного класса нуклеиновых кислот (от ДНК к ДНК или у некоторых вирусов от РНК к РНК).
2. Транскрипция– перенос информации между разными классами нуклеиновых кислот, бывает прямая (от ДНК к РНК) и обратная (от РНК к ДНК).
3. Трансляция –перенос генетической информации от мРНК к белку.
Центральная догма молекулярной биологии отражает направление переноса генетической информации в клетке: от ДНК через РНК к белку. Согласно ей, не может быть переноса информации от белка к РНК, но допускается перенос от РНК к ДНК. То есть, генетическая информация существует только в форме нуклеиновой кислоты и не может передаваться от аминокислотных последовательностей белка.
Биосинтез ДНК
Удвоение ДНК у эукариот проходит в S-фазу клеточного цикла. Инициацию репликации регулируют специфические сигнальные белковые молекулы – факторы роста. Они связываются с рецепторами клеточных мембран, генерируя сигнал, который и побуждает клетку к началу репликации. Одними из первых активируются гены, кодирующие белки циклины. Циклинзависимые киназы, связывая циклин, переходят в активную форму и фосфорилируют специфические белки, которые регулируют синтез ферментов, обеспечивающих репликацию.
Синтез новых цепей ДНК может произойти только при расхождении родительских цепей. В точке начала репликаци (сайты инициации или ориджины) происходит локальное расхождение цепей ДНК и образуются две репликативные вилки, движущиеся в противоположных направлениях.
В образовании репликативной вилки принимает участие ряд белков и ферментов (Рис. 6.1.):
· семейство ДНК-топоизомераз обеспечивает устранение суперспирализации.
· ДНК-хеликазы,используя энергию АТФ, осуществляют разрыв водородных связей между полинуклеотидными цепями и расплетают двойную спираль ДНК.
В поддержании этого участка ДНК в раскрученном состоянии участвуют ДНК-связывающие белки (ДСБ). Они связываются с одноцепочечной ДНК по всей длине разделившихся цепей, предотвращая их комплементарное взаимодействие.
Репликация ДНК осуществляется ДНК-зависимыми ДНК-полимеразами. Субстратами и одновременно источниками энергии для синтеза служат дАТФ, дГТФ, дЦТФ и дТТФ. Ферменты проявляют каталитическую активность только в присутствии предварительно раскрученной матричной двухцепочечной ДНК. Синтез цепей происходит в направлении 5¢®3¢ растущей цепи. Матричная цепь всегда считывается в направлении 3¢®5¢, т. е. синтезируемая цепь всегда антипараллельна матричной цепи. В ходе репликации образуются 2 дочерние цепи, представляющие собой копии матричных цепей.
В синтезе эукариотических ДНК принимают участие 5 ДНК-полимераз. ДНК-полимераза g обеспечивает репликацию только митохондриальной ДНК. ДНК-полимеразы a, b, d, e участвуют в синтезе ДНК в ядре клеток.
Инициирует репликацию ДНК-полимераза a. Фермент обладает сродством к определенному сайту одноцепочечной ДНК. Присоединяясь к нему, ДНК-полимераза синтезирует небольшой фрагмент РНК – праймер, состоящий из 8-10 рибонуклеотидов, к которому присоединяет еще около 50 дезоксирибонуклеотидов. Таким образом, ДНК-полимераза a синтезирует олигонуклеотид, состоящий из короткой последовательности РНК и фрагмента цепи ДНК.
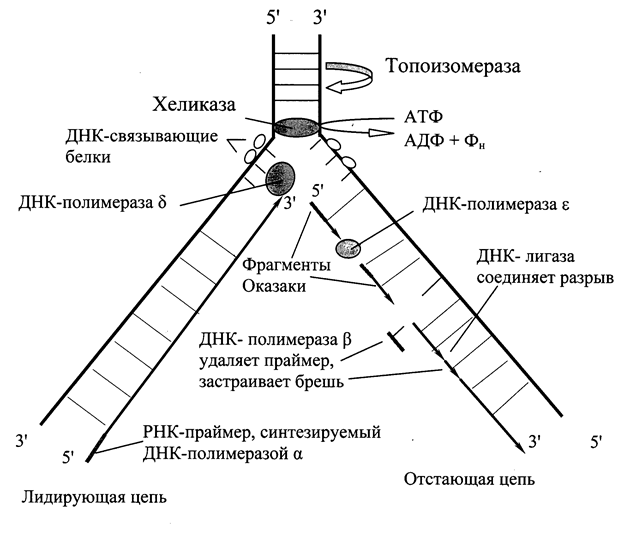
Рис. 6.1. Репликация ДНК
Олигонуклеотид, синтезированный ДНК-полимеразой a и образующий небольшой двухцепочечный фрагмент с матрицей, позволяет присоединиться ДНК-полимеразе d и продолжить синтез новой цепи в направлении 5¢®3¢ по ходу раскручивания репликативной вилки. Выбор ДНК-полимеразой очередного нуклеотида определяется матрицей: включение нуклеотида в синтезируемую цепь ДНК невозможно без предварительного связывания азотистого основания водородными связями с комплементарным нуклеотидом матричной цепи.
В каждой репликативной вилке идет одновременно синтез двух дочерних цепей. Направление синтеза цепи ДНК совпадает с направлением движения репликативной вилки лишь для одной из вновь синтезируемых цепей (лидирующая цепь). На второй матричной цепи синтез новой цепи осуществляется двумя ферментами: ДНК-полимеразой a и ДНК-полимеразой eв направлении 5¢®3¢, но противдвижения репликативной вилки. Поэтому вторая цепь синтезируется прерывисто, короткими фрагментами, которые по имени открывшего их исследователя называют «фрагменты Оказаки».Дочернюю цепь, синтез которой происходит фрагментами, а потому отстает, называют отстающей цепью.
Каждый фрагмент Оказаки содержит праймер. Праймеры удаляет ДНК-полимераза b,после чего присоединяет к ОН-группе на 3¢-конце предыдущего фрагмента дезоксирибонуклеотиды в количестве, равном вырезанному фрагменту и таким образом заполняет брешь, возникающую при удалении рибонуклеотидов.
ФерментДНК-лигазакатализирует образование фосфодиэфирной связи между 3¢-ОН-группой дезоксирибозы одного фрагмента и 5¢-фосфатом следующего. Реакция протекает с затратой энергии АТФ. Таким образом из множества фрагментов Оказаки образуется непрерывная цепь ДНК.
Терминация синтеза ДНК наступает вследствие исчерпания матрицы при встрече двух репликативных вилок.
После окончания репликации происходит метилирование вновь образованных цепей ДНК. Наличие СН3-групп необходимо для формирования структуры хромосом, а также для регуляции транскрипции генов.
На каждом конце хромосомы имеются неинформативные повторяющиеся последовательности нуклеотидов – теломеры.В соматических клетках с каждым актом репликации теломеры укорачиваются из-за невозможности достроить ДНК на месте 5¢-праймера. Это укорочение является важным фактором, определяющим продолжительность жизни клетки. Однако в эмбриональных и других быстро делящихся клетках потери концов хромосом недопустимы, так как укорочение хромосом будет происходить очень быстро. У эукариотических клетках имеется фермент теломераза, обеспечивающий восстановление недореплицированных 5¢-концов. В большинстве клеток теломераза неактивна, так как соматическая клетка имеет длину теломерной ДНК, достаточную для времени жизни клетки и её потомства. Небольшая активность теломеразы обнаруживается в клетках с высокой скоростью обновления, таких как лимфоциты, стволовые клетки костного мозга, клетки эпителия и т.д.
Репарация ДНК
Высокая стабильность ДНК обеспечивается не только консервативностью её структуры и высокой точностью репликации, но и наличием в клетках всех живых организмов специальных систем репарации, устраняющих из ДНК возникающие в ней повреждения.
Действие различных химических веществ, ионизирующей радиации а также ультрафиолетового излучения может вызвать следующие нарушения структуры ДНК:
· повреждения одиночных оснований (дезаминирование, ведущее к превращению цитозина в урацил, аденина в гипоксантин; алкилирование оснований; включение аналогов оснований, инсерции и делеции нуклеотидов);
· повреждение пары оснований (образование тиминовых димеров);
· разрывы цепей (одиночные и двойные);
· образование перекрестных связей между основаниями, а также сшивок ДНК-белок.
Некоторые из указанных нарушений могут возникать и спонтанно, т.е. без участия каких-либо повреждающих факторов.
Любой тип повреждений ведет к нарушению вторичной структуры ДНК, что является причиной частичного или полного блокирования репликации. Такие нарушения конформации и служат мишенью для систем репарации. Процесс восстановления структуры ДНК основан на том, что генетическая информация представлена в ДНК двумя копиями – по одной в каждой из цепей двойной спирали. Благодаря этому повреждение в одной из цепей может быть удалено репарационным ферментом, а данный участок цепи ресинтезирован в своем нормальном виде за счет информации, содержащейся в неповрежденной цепи.
В настоящее время выявлены три основных механизма репарации ДНК: фотореактивация, эксцизионная и пострепликативнаярепарация. Последние два типа называются также темновой репарацией.
Фотореактивация заключается в расщеплении ферментом фотолиазой, активируемой видимым светом, тиминовых димеров, возникающих в ДНК под действием ультрафиолетового излучения.
Эксцизионнаярепарация заключается в узнавании повреждения ДНК, вырезании поврежденного участка, ресинтезе ДНК по матрице интактной цепочки с восстановлением непрерывности цепи ДНК. Такой способ называют также репарацией по типу выщепления – замещения, или более образно механизм «режь – латай». Эксцизионная репарация представляет собой многоэтапный процесс и заключается в:
1) «узнавании» повреждения;
2) надрезании одной цепи ДНК вблизи повреждения (инцизии);
3) удалении поврежденного участка (эксцизии);
4) ресинтезе ДНК на месте удаленного участка;
5) восстановлении непрерывности репарируемой цепи за счет образования фосфодиэфирных связей между нуклеотидами
(Рис 6.2)
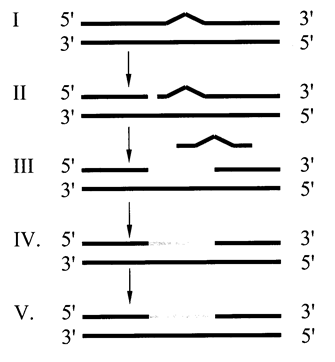
Рис. 6.2 Схема эксцизионной репарации
Репарация начинается с присоединения ДНК-N-гликозилазы к поврежденному основанию. Существует множество ДНК-N-гликозилаз, специфичных к разным модифицированным основаниям. Ферменты гидролитически расщепляют N-гликозидную связь между измененным основанием и дезоксирибозой, это приводит к образованию АП (апуринового-апиримидинового) сайта в цепи ДНК (первый этап). Репарация АП-сайта может происходить при участии только ДНК-инсертазы, которая присоединяет к дезоксирибозе основание в соответствии с правилом комплементарности. В этом случае нет необходимости разрезать цепь ДНК, вырезать неправильный нуклеотид и репарировать разрыв. При более сложных нарушениях структуры ДНК необходимо участие всего комплекса ферментов, участвующих в репарации (Рис. 6.2.): АП-эндонуклеаза распознает АП-сайт и разрезает возле него цепь ДНК (II этап). Как только в цепи возникает разрыв, в работу вступает АП-экзонуклеаза, которая удаляет фрагмент ДНК, содержащий ошибку (III этап). ДНК-полимераза b застраивает возникшую брешь по принципу комплементарности (IV этап). ДНК-лигаза соединяет 3¢-конец вновь синтезированного фрагмента с основной цепью и завершает репарацию повреждения (V этап).
Пострепликативнаярепарация включается в тех случаях, когда эксцизионная не справляется с устранением всех повреждений ДНК до её репликации. В этом случае воспроизведение поврежденных молекул приводит к появлению ДНК с однонитевыми пробелами, а нативная структура восстанавливается при рекомбинации.
Врожденные дефекты системы репарации являются причиной таких наследственных заболеваний, как пигментная ксеродерма, атаксия-телеангиэктазия, трихотиодистрофия, прогерия.
Биосинтез РНК
Транскрипция – первая стадия реализации генетической информации в клетке. В ходе этого процесса происходит синтез цепи РНК, нуклеотидная последовательность которой комплементарна последовательности одной из цепей ДНК. В отличие от репликации, при которой копируется вся хромосома, транскрипция протекает избирательно. Процесс управляется особыми регуляторными последовательностями, указывающими начало и конец участков ДНК, подлежащих транскрипции. Единицы процесса транскрипции несут информацию о структуре одного или нескольких белков. Участок ДНК, в котором заключена информация о структуре одного белка, называется структурным геном.Внутри этих участков существуют разрывы – интроны, которые не несут генетической информации, относящейся к синтезу белка, кодируемого данным геном. Кодирующие части гена называются экзонами.
Субстратами и одновременно источниками энергии для транскрипции являются рибонуклеозидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ). Процесс осуществляется ДНК-зависимой РНК-полимеразой, которая у большинства изученных организмов представляет собой комплекс 4 и более неидентичных субъединиц, выполняющих разные роли. В ядрах эукариот обнаружены 3 специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая 45 S пре-рРНК; РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК и 5 S рРНК.
В процессе транскрипции различают 3 стадии: инициацию, элонгацию и терминацию (Рис. 6.3). Инициация начинается с активации промотора (знак начала транскрипции). Это происходит при участии особого белка – ТАТА-фактора, называемого так потому, что он взаимодействует со специфической последовательностью нуклеотидов промотора – ТАТААА- (ТАТА-бокс). Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение конформации фермента и раскручивание спирали ДНК с образованием транскрипционной вилки, в которой матрица ДНК доступна для инициации синтеза цепи РНК. РНК-полимераза синтезирует небольшой олигонуклеотид. После этого к ней присоединяются факторы элонгации, значительно повышающие активность фермента и облегчающие расхождение цепей ДНК. РНК-полимераза перемещается вдоль молекулы ДНК и копирует одну из её цепей, последовательно присоединяя нуклеотиды в образующейся РНК в соответствии с принципом комплементарности. Синтез цепи РНК идет от 5¢- к 3¢-концу, при этом матричная цепь ДНК всегда антипараллельна синтезируемой мРНК. По мере движения РНК-полимеразы растущая цепь РНК отходит от матрицы, а двойная спираль ДНК позади фермента восстанавливается. Когда РНК-полимераза достигает конца копируемого участка (терминатора), фермент и первичный транскрипт отделяются от матрицы. Этот этап происходит с участием факторов терминации.
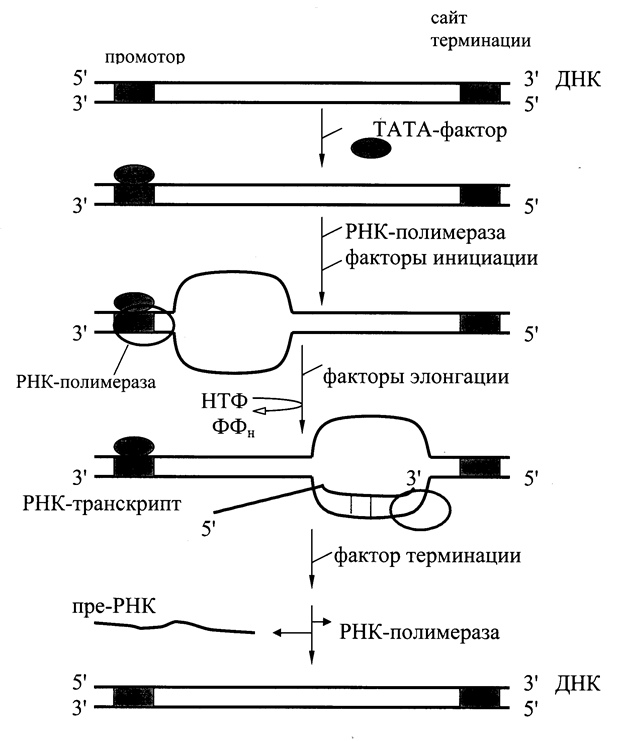
Рис. 6.3. Схема процесса транскрипции
Дата добавления: 2015-12-22; просмотров: 2556;
