Транспорт кислорода
Практически весь 02 (около 20 об%- 20 мл 02 на 100 мл крови) переносится кровью в виде химического соединения с гемоглобином. В виде физического растворения транспортируется только 0,3 об%. Однако эта фаза весьма важна, так как 02 из капилляров к тканям и 02 из альвеол в кровь и в эритроциты проходит через плазму крови в виде физически растворенного газа.
А. Свойства гемоглобина и его соединения. Этот красный кровяной пигмент, содержащийся в эритроцитах как переносчик 02, обладает замечательным свойством присоединять 02, когда кровь находится в легком, и отдавать 02, когда кровь проходит по капиллярам всех органов и тканей организма. Гемоглобин является хромопротеидом, его молекулярный вес составляет 64 500, он состоит из четырех одинаковых групп - гемов. Гем представляет собой протопорфирин, в центре которого расположен ион двухвалентного железа, играющего ключевую роль в переносе 02. Кислород образует обратимую связь с гемом, причем валентность железа не изменяется. При этом восстановленный гемоглобин (НЬ) становится окисленным НЬ02, точнее, НЬ(02)4 Каждый гем присоединяет по одной молекуле'кислорода, поэтому одна молекула гемоглобина связывает четыре молекулы 02. Содержание гемоглобина в крови у мужчин 130-160 г/л, у женщин 120-140 г/л. Количество 02, которое может быть связано в 100 мл крови, у мужчин составляет около 20 мл (20 об%) - кислородная емкость крови, у женщин она на 1-2 об% меньше, так как у них меньше НЬ. После разрушения старых эритроцитов в норме и в результате патологических процессов прекращается и дыхательная функция гемоглобина, поскольку он частично «теряется» через почки, частично фагоцитируется клетками мононуклеарной фагоцитирующей системы.
Гем может подвергаться не только оксигенации, но и истинному окислению. При этом железо из двухвалентного превращается в трехвалентное. Окисленный гем носит название гематина (метгема), а вся полипептидная молекула в целом - метгемоглоби-на. В крови человека в норме метгемоглобин содержится в незначительных количествах, но при отравлениях некоторыми ядами, при действии некоторых лекарств, например, кодеина, фенацетина, его содержание увеличивается. Опасность таких состояний заключается в том, что окисленный гемоглобин очень слабо диссоциирует (не отдает 02 тканям) и, естественно, не может присоединять дополнительно молекулы 02, то-есть он теряет свои свойства переносчика кислорода. Так же опасно соединение гемоглобина с угарным газом (СО) - карбоксигемоглобин, поскольку сродство
гемоглобина к СО в 300 раз больше, чем к кислороду, и НЬСО диссоциирует в 10 000 раз медленнее, чем НЬ02. Даже при крайне низких парциальных давлениях угарного газа гемоглобин превращается в карбоксигемоглобин: НЬ+СО = НЬСО. В норме на долю НЬСО приходится лишь 1 % общего количества гемоглобина крови, у курильщиков - значительно больше: к вечеру оно достигает 20%. Если в воздухе содержится 0,1% СО, то около 80% гемоглобина переходит в карбоксигемоглобин и выключается из транспорта 02. Опасность образования большого количества НЬСО подстерегает пассажиров на автомобильных дорогах. Известно много случаев со смертельным исходом при включении двигателя автомобиля в гараже в холодное время года с целью обогрева. Первая помощь пострадавшему заключается в немедленном прекращении его контакта с угарным газом.
Б. Образование оксигемоглобина происходит в капиллярах легких очень быстро. Время полунасыщения гемоглобина кислородом составляет всего лишь 0,01 с (длительность пребывания крови в капиллярах легких в среднем 0,5 с). Главным фактором, обеспечивающим образование оксигемоглобина, является высокое парциальное давление 02 в альвеолах (100 мм рт.ст.).
Пологий характер кривой образования и диссоциации оксиге-* моглобина в верхней ее части свидетельствует о том, что в случае значительного падения Ро2 в воздухе содержание 02 в крови будет сохраняться достаточно высоким (рис. 7.6). Так, даже при падении Ро2 в артериальной крови до 60 мм рт.ст. (8,0 кПа) насыщение гемоглобина кислородом равно 90% - это весьма важный биологический факт: организм все еще будет обеспечен 02 (например, при подъеме в горы, полетах на низких высотах - до 3 км), т. е. имеется высокая надежность механизмов обеспечения организма кислородом.
Процесс насыщения гемоглобина кислородом в легких отражает верхняя часть кривой от 75 % до 96-98%. В венозной крови, поступающей в капилляры легких, Ро2 равно 40 мм рт.ст. и достигает в артериальной крови 100 мм рт.ст., как Ро2 в альвеолах. Имеется ряд вспомогательных факторов, способствующих оксигенации крови: 1) отщепление от карбгемоглобина С02 и удаление его (эффект Вериго); 2) понижение температуры в легких; 3) увеличение рН крови (эффект Бора). Следует также отметить, что с возрастом связывание 02 гемоглобином ухудшается.
В. Диссоциация оксигемоглобина происходит в капиллярах, когда кровь от легких приходит к тканям организма. При этом гемоглобин не только отдает 02 тканям, но и присоединяет образовавшийся в тканях С02. Главным фактором, обеспечивающим
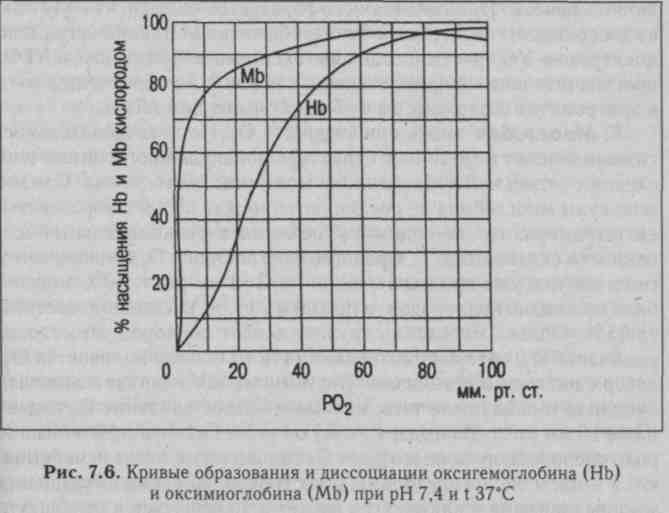
диссоциацию оксигемоглобина, является падение Ро2, который быстро потребляется тканями. Образование оксигемоглобина в легких и диссоциация его в тканях проходят в пределах одного и того же верхнего участка кривой (75-96% насыщения гемоглобина кислородом). В межклеточной жидкости Ро2 уменьшается до 5-20 мм рт.ст., а в клетках падает до 1 мм рт.ст. и меньше (когда Ро2 в клетке становится равным 0,1 мм рт.ст., клетка погибает). Поскольку возникает большой градиент Ро2 (в пришедшей артериальной крови он около 95 мм рт.ст.), диссоциация оксигемоглобина идет быстро, и 02 переходит из капилляров в ткань. Длительность полудиссоциаций равна 0,02 с (время прохождения каждого эритроцита через капилляры большого круга около 2,5 с), что достаточно для отщепления 02 (огромный запас времени).
Кроме главного фактора (градиента Ро2) имеется и ряд вспомогательных факторов, способствующих диссоциации оксигемоглобина в тканях. К ним относятся: 1) накопление С02 в тканях; 2) закисление среды; 3) повышение температуры.
Таким образом, усиление метаболизма любой ткани ведет к улучшению диссоциации оксигемоглобина. Кроме того, диссоциации оксигемоглобина способствует 2,3-дифосфоглицерат - промежуточный продукт, образующийся в эритроцитах при расщеп-
лении глюкозы. При гипоксии его образуется больше, что улучшает диссоциацию оксигемоглобина и обеспечение тканей организма кислородом. Ускоряет диссоциацию оксигемоглобина также и АТФ,но в значительно меньшей степени, так как 2,3-дифосфоглицерата в эритроцитах содержится в 4-5 раз больше, чем АТФ.
Г. Миоглобин также присоединяет 02. По последовательности аминокислот и третичной структуре молекула миоглобина очень сходна с отдельной субъединицей молекулы гемоглобина. Однако молекулы миоглобина не соединяются между собой с образованием тетрамера, что, по-видимому, объясняет функциональные особенности связывания 02. Сродство миоглобина к 02 больше, чем у гемоглобина: уже при напряжении Ро2 3-4 мм рт.ст. 50% миоглобина насыщено кислородом, а при 40 мм рт.ст. насыщение достигает 95%. Однако миоглобин труднее отдает кислород. Это своего рода запас 02, который составляет 14% от общего количества 02, содержащегося в организме. Оксимиоглобин начинает отдавать кислород только после того, как парциальное давление 02 падает ниже 15 мм рт.ст. Благодаря этому он играет в покоящейся мышце роль кислородного депо и отдает 02 только тогда, когда исчерпываются запасы оксигемоглобина, в частности, во время сокращения мышцы кровоток в капиллярах может прекращаться в результате, их сдавливания, мышцы в этот период используют запасенный во время расслабления кислород. Это особенно важно для сердечной мышцы, источником энергии которой является в основном аэробное окисление. В условиях гипоксии содержание миоглобина возрастает. Сродство миоглобина с СО меньше, чем гемоглобина.
Дата добавления: 2015-12-22; просмотров: 1219;
