БУДОВА ПЕПТИДІВ І БІЛКІВ
Внаслідок взаємодії аміно- та карбоксильних груп a-амінокислоти здатні до поліконденсації. Поліаміди, котрі утворюються при цьому, називають пептидами:
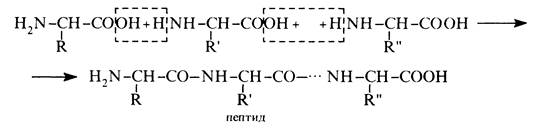
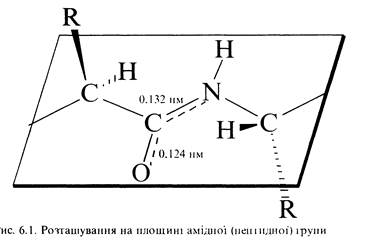
Амідний зв'язок (—СОNН—) між двома a-амінокислотними фрагментами називається пептидним зв'язком. Атом вуглецю пептидної групи знаходиться в sp2-гібридизованому стані. Неподільна пара електронів атома азоту вступає в спряження з p-електроном карбонільної групи, в результаті чого подвійний зв'язок С=О дещо подовжується (124 нм замість 121 нм у звичайного зв'язку), а зв'язок С- N дещо вкорочується (132 нм замість 147 нм), і, відповідно, набуває в значній мірі характеру подвійного зв'язку, обертання навколо котрого утруднене. Таким чином, електронна будова зумовлює жорстку площинну структуру пептидної групи.
Наявність пептидного зв'язку в молекулах пептидів і білків підтверджується біуретовою реакцією: при взаємодії з лужним розчином
сульфату міді утворюється фіолетове забарвлення.
У залежності від кількості амінокислотних залишків у ланцюзі пептиди поділяють на ди-, три-, тетрапептиди і т.д. Пептиди з молекулярною масою меншою ніж 10000 умовно відносять до поліпептидів, а з більшою ніж 10000—до білків. Тому між білками та пептидами важко провести чітку межу, проте білки мають складнішу структуру.
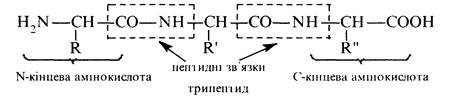
Незважаючи на величезне різноманіття білків і пептидів у природі будова їх поліпептидного (поліамідного) ланцюга однакова. Він складається з пептидних (СОNH) і метинових (СН) груп, які чергуються. На одному кінці ланцюга знаходиться амінокислота з вільною аміногрупою (N-кінцева амінокислота), а на іншому — амінокислота з вільною карбоксильною групою (С-кінцева амінокислота). Пептидні та білкові ланцюги прийнято записувати так. щоб N-кінцева амінокислота знаходилася ліворуч, а С-кінцева амінокислота праворуч:
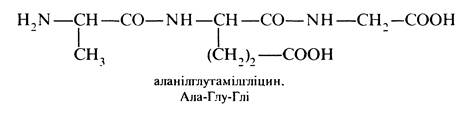
Назви пептидів утворюються шляхом послідовного перелічування всіх амінокислот, починаючи з N-кінцевої амінокислоти, причому назви амінокислот, крім останньої, набувають суфікса -ил (-іл). За цією ж послідовністю пишуть також скорочені позначення:
Визначену послідовність a-амінокислот, які входять у певний поліпептидний ланцюг, називають первинною структурою пептиду або білка. Зміна амінокислотної послідовності призводить до порушення або зникнення біологічної активності білка. Білки відрізняються від пептидів складнішим рівнем структури. В структурній організації білків, крім первинної, розрізняють вторинну, третинну та четвертинну структури.
Вторинною структурою білків називають просторове розташування (просторове укладання) атомів основного поліпептидного ланцюга. Розрізняють два типи вторинної структури білків a-спіраль і складчасту b-структуру. aСпіраль має просторову форму, подібну до правозакручених гвинтових східців (рис. нижче). Оскільки вона побудована зі фрагментів, які повторюються (-NН-Сa-СО), то розміри її доволі постійні. На один виток спіралі припадає приблизно 3,6 амінокислотного залишку, що відповідає лінійній відстані вздовж вісі спіралі 0,54 нм. Діаметр спіралі дорівнює 0,5 нм. Крок спіралі (відстань між однаковими атомами) становить поліпептидного ланцюга 015 нм.
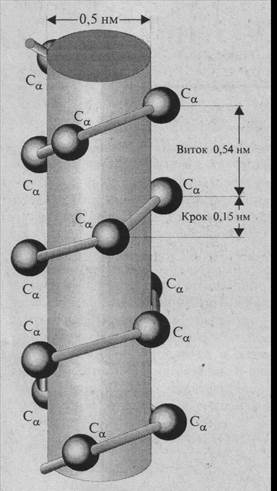
У формуванні спіральної структури основну роль виконують водневі зв'язки, котрі утворюються між групами СО та NН, розділеними трьома амінокислотними залишками. Водневі зв'язки майже паралельні вісі спіралі, а оскільки в утворенні водневого зв'язку береучасть кожна група С=О та NН a-спіралі, то це робить конформацію вельми стійкою.
Найчастіше поліпептидні ланцюги в білках спіралізуються не повністю. Наприклад, залишки проліну та оксипроліну не містять атомів водню в пептидній групі, та, відповідно, не беруть участі в утворенні водневих зв'язків: поліпептидний ланцюг на цих ділянках просто зігнутий. Ізопропільна група валіну також створює стеричні перешкоди для спіралізації.
Іншим типом вторинної структури є так звана складчаста b-структура, в якій окремі поліпептидні ланцюги в зигзагоподібній конформації укладені паралельно один одному та зв'язані між собою численними водневими зв'язками. Якщо поліпептидні ланцюги мають однаковий напрямок від N- до С-кінця, то утворюється паралельна складчаста b-структура, а якщо протилежний антипаралельна. У b-структурі бокові групи амінокислотних залишків знаходяться вище та нижче умовної площини, проведеної крізь структуру.
Поліпептидний ланцюг, що має той або інший тип вторинної структури, здатний певним чином скручуватись у просторі, що і визначає третинну структуру білка, тобто загальну форму поліпептидного ланцюга. Третинна структура, крім водневих зв'язків, стабілізується іонними (між додатковими карбоксильними і аміногрупами) та ковалентними (дисульфідні містки в цистині) зв'язками, а також гідрофобною взаємодією (ван-дер-ваальсові сили притягання між неполярними боковими групами амінокислотних залишків).
Третинна структура білків формується також під впливом водного середовища клітини, що пов'язане зі здатністю води гідратувати деякі гідрофільні бокові групи амінокислотних залишків і зміщувати всередину білкової молекули гідрофобні групи.
Четвертинна структура білка властива макромолекулам, до складу яких входять декілька поліпептидних ланцюгів (субодиниць), сполучених між собою нековалентними зв'язками.
Для виявлення пептидом специфічних функцій в організмі необхідно відтворити лише його первинну структуру, а у випадку білка — відтворити всі його конформаційні особливості.
Окреме місце у розвитку хімії білків займає визначення поліпептидної структури гормонів вазопресину, окситоцину та інсуліну. В 1953 р. американський біохімік В. де Віньо розшифрував будову гормонів гіпофізу окситоцину та вазопресину. Ним установлено, що спільним структурним елементом цих гормонів є пептид з дев'яти амінокислотних залишків з дисульфідним зв'язком між четвертим і дев'ятим з них. Ці гормони відрізняються лише двома амінокислотними фрагментами: замість лейцину та ізолейцину в окситоцині (а) вазопресин (б) містить аргінін і фенілаланін:
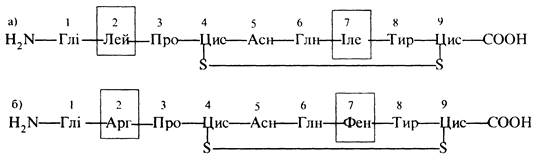
При цьому окситоцин викликає скорочення гладкої мускулатури, зокрема матки, а вазопресин підтримує баланс рідини в організмі.
Десять років (1943-1953 рр.) знадобилося англійському біохіміку Ф.Сенгеру для розшифрування структури гормону підшлункової залози — інсуліну. Ним установлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, сполучених між собою дисульфідними містками: А-ланцюг містить 21 амінокислотний залишок і додатковий дисульфідний зв'язок, завдяки котрому інсулін у просторі утворює петлю, а Б-ланцюг ЗО залишків:
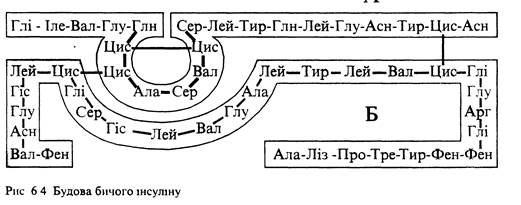
У 1963-1964 рр. було синтезовано обидва поліпептидні ланцюги інсуліну. Інсулін різних видів тварин і людини відрізняється за будовою. Ці структурні розбіжності припадають на ділянку 8-10 ланцюга А. Інсулін регулює вміст глюкози в крові, нестача його в організмі викликає цукровий діабет.
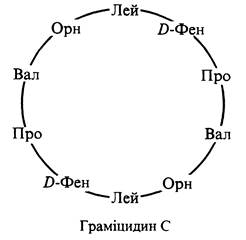
До поліпептидів відносяться деякі широко застосовувані антибіотики, наприклад, граміцидин С— циклічний декапептид, використовуваний для лікування захворювань, викликаних стрептококами, пневмококами та ін. До складу граміцидину С, крім амінокислотних залишків L-ряду, входять два залишки D-фенілаланіну:
СИНТЕЗ ПЕПТИДІВ
В основі синтезу пептидів лежить процес утворення пептидного (амідного) зв'язку між карбоксильною групою одної a-амінокислоти та аміногрупою — іншої. Спрощено цей процес можна подати такою cхемою:
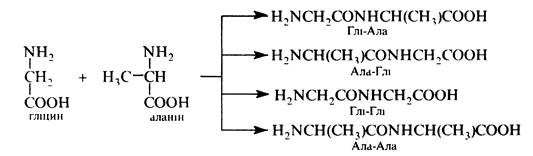
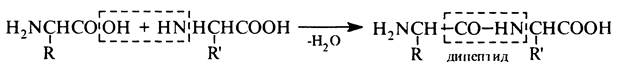 Проте, через неполярну природу a-амінокислот (цвіттер-іонна структура) проведення реакції потребує дуже високих температур, що сприяє різним небажаним побічним процесам, наприклад, циклізації з утворенням дикетопшеразинів та ін. Крім того, в процесі синтезу виникають складнощі, пов'язані з необхідністю сполучати залишки a-амінокислот у певній послідовності. Наприклад, при взаємодії гліцину і аланіну можливе утворення чотирьох дипептидів:
Проте, через неполярну природу a-амінокислот (цвіттер-іонна структура) проведення реакції потребує дуже високих температур, що сприяє різним небажаним побічним процесам, наприклад, циклізації з утворенням дикетопшеразинів та ін. Крім того, в процесі синтезу виникають складнощі, пов'язані з необхідністю сполучати залишки a-амінокислот у певній послідовності. Наприклад, при взаємодії гліцину і аланіну можливе утворення чотирьох дипептидів:
У зв'язку з цим для проведення цілеспрямованого синтезу слід створити такі умови, за котрих одна з амінокислот взаємодіяла б своєю карбоксильною групою, а інша — аміногрупою. З цією метою здійснюють захист функціональних груп (-NН2 та -СООН), які не беруть участі в утворенні пептидного зв'язку. Захисні групи обирають таким чином, щоб потім кожну з них незалежно одна від одної можна було б легко видалити, не руйнуючи при цьому пептидного зв'язку.
Для захисту аміногруп використовують реакцію ацилювання, найчастіше бензилоксикарбонілхлоридом або трет-бутоксикарбоксазидом. Важливою властивістю карбобензокси- та трет-бутоксикарбонільних груп є те, що вони надійно захищають хіральний центр амінокислот від рацемізації. Карбобензоксигрупу видаляють каталітичним гідрогенолізом, а трет-бутоксикарбонільну за допомогою трифтороцтової кислоти. Для захисту карбоксильної групи викорис товують реакцію етерифікації.
Крім того, з метою підвищення ефективності процесу амідування здійснюють активацію карбоксильної групи N-захищеної амінокислоти шляхом перетворення її на хлорангідрид або на змішаний ангідрид (найчастіше взаємодією з етилхлорформіатом). Нижче наведено схему синтезу дипептиду аланіл-гліцину.
Дата добавления: 2015-12-17; просмотров: 3375;
