Закон Гесса. Следствие закона Гесса
Закон, сформулированный Германом Ивановичем Гессом в 1840 году (закон Гесса), – основной закон термохимии:
· энтальпия химической реакции зависит только от природы и состояния исходных и конечных веществ и не зависит от числа и характера промежуточных стадий, т.е. от пути процесса.
Из закона Гесса следует, что термохимические уравнения можно складывать и вычитать так же, как и алгебраические.
Следствие закона Гесса:
· энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ с учётом стехиометрических коэффициентов.
Как правило, оперируют со стандартными величинами, т.е.
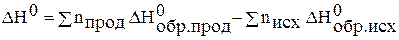 ,
,
где 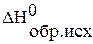 ,
, 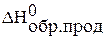 – стандартные энтальпии образования исходных веществ и продуктов реакции;
– стандартные энтальпии образования исходных веществ и продуктов реакции; 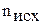 ,
,  - стехиометрические коэффициенты.
- стехиометрические коэффициенты.
Аналогичным образом можно рассчитывать изменение и других функций – энтропии (DS), энергии Гиббса (DG).
Энтропия
Энтропия (S) – количественная мера беспорядка в системе. Размерность -  . Чем беспорядочней система, тем больше значение энтропии. В таблицах термодинамических величин приводят
. Чем беспорядочней система, тем больше значение энтропии. В таблицах термодинамических величин приводят  значения стандартных энтропий веществ S0. Стандартная энтропия простых веществ не равна нулю. За нуль принимают энтропию совершенного кристалла любого вещества при абсолютном нуле температуры.
значения стандартных энтропий веществ S0. Стандартная энтропия простых веществ не равна нулю. За нуль принимают энтропию совершенного кристалла любого вещества при абсолютном нуле температуры.
Процессы и реакции, сопровождающиеся увеличением беспорядка в системе: нагревание, расширение, кипение, плавление, растворение, увеличение количества газообразных веществ, - приводят к увеличению энтропии. Процессы, связанные с уменьшением беспорядка в системе, приводят к уменьшению энтропии: охлаждение, конденсация, сжатие, кристаллизация, реакции, сопровождающиеся уменьшением количества газообразных веществ.
Например, оценим изменение энтропии системы в химической реакции:
С(ГРАФИТ) + СО2(Г) = 2СО(Г).
В результате реакции возрастает количество газа, т.е. беспорядок возрастает, и энтропия должна увеличиваться.
| Вещество | С(ГРАФИТ) | СО2(Г) | СО(Г) |
S0, 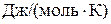
| 1,36 | 51,06 | 47,3 |
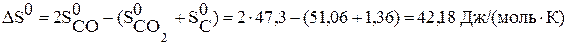 .
.
Расчет подтвердил, что энтропия системы возрастает.
Дата добавления: 2015-12-16; просмотров: 884;
