Скорость химических реакций
Скорости и механизмы химических процессов, а также факторы, влияющие на них, изучает химическая кинетика.
Существуют гомогенные (однофазные) и гетерогенные (многофазные) системы, соответственно называют и реакции, происходящие в таких системах.
· Скорость химической реакции - число элементарных актов реакции в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности фаз (для гетерогенных реакций). О скорости реакции можно судить по изменению количества реагирующих веществ или продуктов реакции.
Скорость химических реакций зависит от многих факторов: природы реагирующих веществ, концентрации, давления, степени дисперсности (измельчения) твёрдых веществ, температуры, присутствия катализатора.
· Математическую зависимость скорости реакции от концентрации 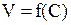 , называемую кинетическим уравнением, устанавливают экспериментально.
, называемую кинетическим уравнением, устанавливают экспериментально.
Для немногочисленных реакций – элементарных, т.е. идущих в одну стадию, зависимость скорости элементарных химических реакций от концентрации подчиняется закону действующих масс:
· скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведённых в степени, равные стехиометрическим коэффициентам.
Например, элементарной реакции 2NO + O2 = 2NO2 cоответствует кинетическое уравнение 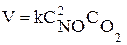 . В этом уравнении
. В этом уравнении 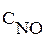 и
и 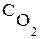 – молярные концентрации веществ (см. с. 16),
– молярные концентрации веществ (см. с. 16), 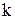 - константа скорости химической реакции, она численно равна скорости реакции при условии, что концентрации реагирующих веществ постоянны и равны единице.
- константа скорости химической реакции, она численно равна скорости реакции при условии, что концентрации реагирующих веществ постоянны и равны единице.
Если в реакции участвуют газы, то вместо концентраций можно использовать их парциальные давления.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа:
· при повышении температуры на каждые десять градусов скорость большинства химических реакций возрастает в 2 – 4 раза.
Математически правило выражают следующим образом:
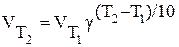 ,
,
где 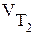 и
и 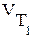 - скорость реакции при температурах
- скорость реакции при температурах 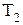 и
и 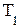 (
( 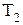 >
> 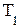 );
);
g - температурный коэффициент скорости, принимающий для разных реакций значения от двух до четырех.
Дата добавления: 2015-12-16; просмотров: 854;
