Основные закономерности распределения электронов в атомах
· Принцип наименьшей энергии:
электроны заполняют орбитали в порядке повышения энергии орбиталей.
· Правило В.М.Клечковского:
заполнение орбиталей электронами происходит в порядке возрастания сумм (n + l); а если для каких-либо орбиталей эта сумма одинакова, то электроны располагаются на орбитали с меньшим значением n.
К примеру, определим очерёдность заполнения электронами 3p-, 3d-, 4s-, 4p- и 4d-подуровней (табл.2).
Таблица 2
| Обозначение подуровня | Значение n | Значение l | 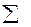 (n+l) (n+l)
| Очерёдность Заполнения |
| 3p 3d 4s 4p 4d |
Расположение орбиталей многоэлектронных атомов в порядке повышения энергии имеет вид:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d»4f<6p<7s<6d»5f<7p¼
· Принцип Паули:
в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
 Следовательно, на каждой орбитали может находиться не более двух электронов с противоположными спинами: ¯ .
Следовательно, на каждой орбитали может находиться не более двух электронов с противоположными спинами: ¯ .
Максимальное число электронов на энергетическом уровне равно 2n2, где n – главное квантовое число (s-подуровень – 2 электрона; p-подуровень – 6 электронов; d-подуровень – 10 электронов и т.д.).
· Правило Гунда:
когда атом находится в устойчивом состоянии, электроны в пределах подуровня располагаются таким образом, чтобы суммарное спиновое число электронов было максимальным.


















 К примеру, три электрона на p-подуровне распределены единственно возможным способом: , а не ¯ или ¯ .
К примеру, три электрона на p-подуровне распределены единственно возможным способом: , а не ¯ или ¯ .
Дата добавления: 2015-12-16; просмотров: 917;
