Вопрос 1. Процесс образования коррозии
Коррозия металлов – электрохимический процесс. В этом процессе участвуют:
анод – участок, на котором происходит потеря (растворение) металла;
катод – участок, на котором металл не разъедается;
электролит – коррозионная среда, в которой развивается процесс.
На анодных участках корродирующий металл переходит в раствор электролита в виде положительно заряженных ионов (рис.32).
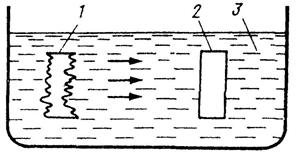
Рис.32. Коррозионный гальванический элемент:
1 – анод; 2 – катод; 3 – электролит
Освобождающиеся при этом электроны переходят от анодных участков к катодным, т.е. возникает коррозионный ток. Скорость коррозии зависит от электропроводности среды.
В процессе коррозии происходит окисление металла с образованием окислов (рис.33). Коррозионная стойкость металла зависит от значения электродного потенциала и физических свойств пленки на поверхности металла. Металлы с большим отрицательным электродным потенциалом корродируют довольно быстро, тогда как металлы с большим положительным электродным потенциалом отличаются высокой коррозионной стойкостью: магний, цинк, алюминий, кадмий – большой отрицательный потенциал, дюралюмин, малоуглеродистая сталь, чугун, нержавеющая сталь, свинец, олово, никель – нейтральный; серебро, титан, золото и платина – положительный потенциал.
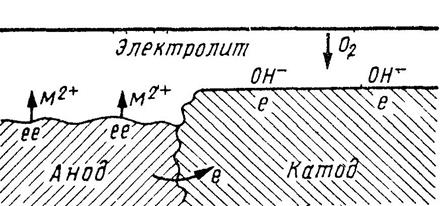
Рис. 33. Реакция в типичном коррозионном гальваническом элементе
Движущая сила коррозии – разность потенциалов. На рис.34 представлен процесс ржавления – окисление железа. Начинается он с того, что электроны начинают отрываться от атомов железа и переходить в электролит в местах нарушения защитного покрытия (возможна миграция через покрытие). При выходе на поверхность электроны реагируют с водой и кислородом с образованием гидроксильных ионов (рис.34, а). На следующей стадии происходит замыкание электрической цепи в электролите, в результате чего образуется ржавчина (рис.34, б). Этот процесс непрерывно повторяется (рис.34, в).
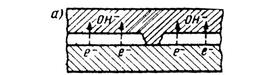
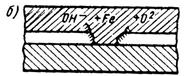
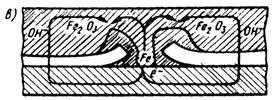
Рис 34. Схематическое образование ржавчины:
а – катодная реакция; б – отложение ржавчины; в – непрерывный коррозионный цикл
Коррозионные поражения ЛА отличаются большим разнообразием (рис. 35).
Коррозия деталей ЛА может также проходить в среде топлив и смазочных масел. Коррозионная активность нефтепродуктов обусловлена несколькими причинами. Прежде всего механизм коррозии связан с взаимодействием серы и ее соединений (сероводород, сульфаты, меркаптаны и т. д.) с поверхностью металла, что приводит к образованию и последующему разрушению пористых, непрочных слоев сульфидов.
В процессе окисления масел образуются низкомолекулярные кислоты (масляная, пропиновая, уксусная, муравьиная), весьма агрессивные по отношению к цветным сплавам. Коррозионная активность масел значительно повышается при попадании в них воды. В этом случае наряду с химическим имеет место электрохимический механизм коррозионного поражения.
Авиационные топлива, масла и специальные жидкости, как правило, содержат присадки химических активных веществ, улучшающие их рабочие свойства. В то же время сера и содержащие серу вещества, хлор и его соединения, а также другие активные элементы могут вызвать значительный рост интенсивности коррозионного поражения, особенно деталей из цветных сплавов.

Рис. 35. Виды коррозионных повреждений
Дата добавления: 2015-12-16; просмотров: 1703;
