Лекция 4. Спектры атомов. Атомная физика. Теория Бора.
1.Теория атома Бора.
Изучая прохождение a-частиц (ядер атомов гелия) через тонкую золотую фольгу, английский ученый Э. Резерфорд обнаружил, что большинство этих частиц свободно проходит через многочисленные слои атомов, и вещество в этих экспериментах ведет себя как крупное сито, свободно пропускающее довольно тяжелые заряженные частицы. Для объяснения полученных результатов Резерфорд разработал так называемую планетарную модель атома, где основная масса сосредоточена в ядре, размеры которого крайне малы, а электроны, входящие в состав атома, вращаются вокруг этого ядра. Планетарная модель хорошо объясняла поведение a- частиц, но противоречила выводам классической физики: двигаясь с ускорением любая заряженная частица должна излучать электромагнитные волны. Энергия электрона в этом случае должна быстро уменьшаться, и он должен упасть на ядро.
Датский физик Н.Бор сумел разрешить это противоречие, сформулировав три постулата, которые легли в основу боровской теории строения атома. Эти постулаты гласили:
1. В атоме существуют стационарные орбиты, на которых электрон не излучает и не поглощает энергии.
2. Радиус стационарных орбит дискретен; его значения должны удовлетворять условиямквантования момента импульса электрона:
m v r = n 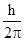 , где n - целое число,
, где n - целое число,
3. При переходе с одной стационарной орбиты на другую электрон испускает или поглощаетквант энергии, причем величина кванта в точности равна разности энергий этих уровней:
hn = E1 – Е2.
Из этих постулатов видно, что фактически Бором были введены новые - квантовые представления о свойствах электрона в атоме. Покажем, что в этих предположениях энергия электрона также становится дискретной (квантуется).
Пусть Ze - заряд ядра атома, вокруг которого вращается один электрон массы m. Радиус орбиты обозначим г, а скорость электрона на орбите - v. Тогда уравнение движения электрона можно записать в следующем виде:
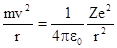 ,
,
где сила, стоящая в правой части этого уравнения, представляет собой кулоновскую силу взаимодействия двух зарядов: е и Ze, a величина v2 /r характеризует центростремительное ускорение электрона. Сокращая знаменатели обеих частей этого уравнения и используя выражение второго постулата Бора, получаем систему из двух уравнений, где неизвестными являются скорость v и радиус орбиты r :
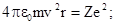
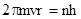 .
.
Деля почленно одно уравнение на другое, получаем: v = 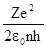 . Подставим выражение для скорости во второе уравнение нашей системы и найдем выражение для радиуса орбиты:
. Подставим выражение для скорости во второе уравнение нашей системы и найдем выражение для радиуса орбиты:
r = 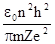 .
.
Общая энергия электрона на орбите складывается из его кинетической энергии и потенциальной энергии его взаимодействия с зарядом ядра:
Wo = Т кин + Uпот ,
или 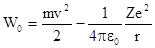 .
.
Знак минус отражает тот факт, что заряд электрона - отрицательный. Подставляя в это выражение полученные ранее значения скорости и радиуса, находим:
W0 = 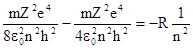 ,
,
где 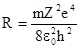 называют постоянной Ридберга .
называют постоянной Ридберга .
Таким образом, общая энергия электрона в атоме оказывается отрицательной, и онаувеличивается с ростом n.
Частота излучения, которое соответствует переходу с орбиты номера n на орбиту с номером m, равна:
n = 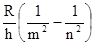 .
.
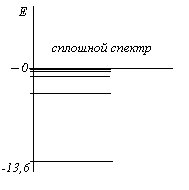 Если атомы являются изолированными и не участвуют в других взаимодействиях, то допускаемые частоты образуют набор отдельных спектральных линий, соответствующих различным значениям чисел n и m. Обычно такое состояние атомов наблюдается в газах. На рисунке изображена энергетическая диаграмма атома водорода. Каждому химическому элементу соответствуют свои спектральные линии - на этом основан спектральный анализ, позволяющий по наблюдаемому набору линий установить химический состав исследуемого объекта. При исследовании спектров испускания наблюдаются узкие светящиеся линии, а если свет проходит через холодный газ, то наблюдаются темные линии на тех местах, которые соответствуют положению линий излучения горячим газом. Эти темные линии называются спектрами поглощения.
Если атомы являются изолированными и не участвуют в других взаимодействиях, то допускаемые частоты образуют набор отдельных спектральных линий, соответствующих различным значениям чисел n и m. Обычно такое состояние атомов наблюдается в газах. На рисунке изображена энергетическая диаграмма атома водорода. Каждому химическому элементу соответствуют свои спектральные линии - на этом основан спектральный анализ, позволяющий по наблюдаемому набору линий установить химический состав исследуемого объекта. При исследовании спектров испускания наблюдаются узкие светящиеся линии, а если свет проходит через холодный газ, то наблюдаются темные линии на тех местах, которые соответствуют положению линий излучения горячим газом. Эти темные линии называются спектрами поглощения.
При очень низких температурах электроны в атомах стремятся занять орбиты с наименьшими значениями энергии, но при конечных температурах за счет энергии теплового движения атомов электроны могут приобретать дополнительную энергию и переходить на более высоколежащие орбиты, степень заселенности которых определяется распределением Больцмана: чем выше значения энергии, тем меньшее количество электронов занимают данный уровень. Поэтому в обычном состоянии атомы больше поглощают электромагнитные волны ( набор разрешенных частот может лежать в любом диапазоне), чем излучают. Для того, чтобы процесс излучения преобладал над процессом поглощения, атому необходимо сообщать энергию. Приобретая эту энергию, атомы переходят в возбужденное состояние, но оно является энергетически невыгодным, и обычно через очень короткий промежуток времени электроны возбужденного атома переходят на орбиты с меньшей энергией. Процесс перехода является случайным, поэтому значение начальной фазы и направления колебаний векторов электрического и магнитного полей изменяются от одного атома к другому хаотическим образом. Получающееся электромагнитное излучение является некогерентным. Однако существует возможность своеобразной синхронизации процессов излучения. Использование такой возможности определяет принцип действия генераторов коротковолнового излучения - мазеров и лазеров.
2. Многоэлектронные атомы
Заряд ядра атома, а, следовательно, и его положение в таблице Менделеева определяется количеством протонов. Число электронов, окружающих ядро, должно соответствовать числу протонов. Вследствие запрета Паули, электроны располагаются на разных энергетических уровнях. Величина энергии зависит от значения главного квантового числа n. Форма орбиты (в рамках теории Бора) определяется орбитальным квантовым числом l, значения которого могут изменяться от ( n-1) до -( n-1). 0рбиты с разными l носят названия: s - оболочек ( l = 0 ), р - оболочек (l = 1), d- (l = 2), f- ( l = 3) и т.д. На каждой оболочке размещается 2( 2l + 1) электронов, т.е. их число равно 2 (одному значению l соответствуют два электрона с противоположными направлениями спинов), 6,10,14 и т.д. Общее число электронов в атомах, где оболочки полностью заполнены равно 2,8,18,32 и т.д. Рассматривая таблицу, можно заметить, что этим числам соответствуют атомы гелия, неона, аргона, криптона и т.д., т.е. атомы инертных газов. Свойства каждого элемента определяются тем, как выгоднее ему достроить свою внешнюю оболочку до замкнутой: отдавая. или получая электроны.
Заполнение оболочек происходит постепенно при переходе от одного элемента к другому, но порядок заполнения может нарушаться для так называемых переходных элементов. Электронам оказывается энергетически выгоднее занимать орбиты с большим квантовым числом, оставляя незаполненной внутреннюю оболочку. По названию незаполненной оболочки переходные элементы образуют 3d-, 4d - и 5d - группы. Отдельные группы образованы редкоземельными и трансурановыми элементами.
3. Недостатки и достоинства теории Бора:
Недостатки:
- теория Бора оказалась неприменимой к многоэлектронным атомам;
- теория Бора является внутренне противоречивой: с одной стороны использует законы классической механики (II закон Ньютона), а с другой стороны постулаты Бора, противоречащие классической механике.
Достоинства:
- теория Бора объясняет спектр водорода;
- теория Бора показала неприменимость законов классической физики к микромиру. Необходимо было создание новой
Дата добавления: 2015-11-06; просмотров: 1916;
