КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
1. ЧТО ТАКОЕ КОРРОЗИЯ?
Термин «коррозия» происходит от латинского слова « соггоdеге», что означает «пожирать, изгладывать»
Коррозия— разрушение металлов в результате химической или электрохимической реакции приводящее к изменениям в свойствах материала. Результатом является «коррозионный эффект», обычно вредный.: порча материалов, загрязнение окружающей среды продуктами коррозии и нарушения функций системы, физико-хим. составными частями которой являются и материал и окружающая среда.
Разрушение (порча), происходящее по физическим причинам, не называется коррозией и известно как эрозия, истирание или износ. В некоторых случаях химическое воздействие сопровождается физическим разрушением и называется коррозионной эрозией, коррозионным износом или фреттинг-коррозиейЭто определение не распространяется на неметаллические материалы. Термин «коррозия» относится только к химическому воздействию на металлы. Ржавлениемназывается коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из гидратированных оксидов железа. Цветные металлы, следовательно, корродируют, но не ржавеют.
2. Структура металлов и ее влияние
на коррозионные процессы
Механизм образования поверхностных соединений, их адгезия к металлу и свойства влияют на процесс коррозии. В свою очередь эти показатели во многом определяются структурой и составом металла.
Большинство металлов за исключением металлических стекол имеют кристаллическую структуру. В узлах кристаллической решетки расположены положительно заряженные ионы, а электроны свободно перемещаются в металле.
Наименьшая часть пространственной решетки, которой присущи все свойства симметрии решетки в целом, называется элементарной ячейкой. Если эта ячейка является кубом, то и соответствующая ей решетка будет кубической. Простой кубической решеткой называется такая решетка, у которой атомами или ионами заняты лишь вер-
шины ее элементарных ячеек. Такой тип решетки имеют, например, кристаллы поваренной соли МаС1.
Решетка, у которой кроме вершин атомом или ионом занят центр, называется объемноцентрированной. Такое кристаллическое строение имеют литий, натрий, калий, ванадий, хром, а-железо (при температурах до 900 °С).
Гранецентрированной называется такая решетка, у которой частицами заняты центры граней ( алюминий, никель, медь, свинец, серебро, золото, платина, 7-железо (в интервале температур 900-1400 °С).)
Гексагональная ячейка имеет в основании шестиугольник. По такому принципу кристаллизуются бериллий, марганец, кадмий, титан и др.
Различают также плотноупакованные кристаллографические плоскости и решетки.
В ряде случаев кристаллографическая структура определяет коррозионную устойчивость металлов и их сплавов.
Реальные металлические материалы, как правило, являются поликристаллическими, то есть состоят из множества отдельных кристаллов, которые в общем случае имеют неправильную форму и называются кристаллитами или зернами. В отличие от идеальных кристаллов, в которых атомы кристаллической решетки расположены строго периодично, реальные кристаллы всегда имеют нарушения регулярности структуры (разупорядоченность), которые называются дефектами.
Основными причинами отсутствия у реальных конструкционных металлических материалов идеального кристаллического состояния являются
- неравновесные условия кристаллизации металла,
- присутствие в его составе легирующих и примесных элементов,
- деформация кристаллической решетки вследствие воздействия на нее в процессе изготовления изделий механических, термических, радиационных и других факторов.
(В настоящее время существует несколько способов классификации дефектов металлических конструкционных материалов:
• по морфологическим признакам — наружные, внутренние, внедрения, в сочленениях и др.;
• по происхождению (генетическим признакам) — литейные, сварочные, термические, деформационные, коррозионные и др;
• по структурным признакам — трещины, поры, избыточные фазы, неметаллические включения, границы зерен и др;
• по геометрическим размерам — макро- (> 1 мм), микро- (~200-1000 мкм) и субмикро- (~ 0,1-200 мкм) дефекты;
• по геометрическим признакам — точечные, линейные, двухмерные.)
Дефекты кристаллических решеток изменяют заданные свойства металлов, влияют на его химические и электрохимические характеристики. Дефекты структуры, выходящие на поверхность металла, обладают повышенной реакционной
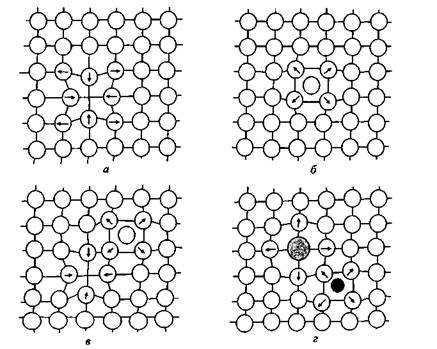
|
Рис. 2.1. Точечные дефекты в кристаллах:
а — вакансия; б — дислоцированный атом; в — дефект Френкеля; г —
примесные атомы внедрения. Стрелками указаны направления смещения
атомов в кристаллической решетке/
способностью и они являются первыми очагами коррозии. Посторонние примеси концентрируются у линейных дислокаций и дырок по границам зерен. Эти сегрегации могут увеличивать окисление металла, облегчать образование питтингов. Любой вид неоднород-ности усиливает как химическую, так и электрохимическую коррозию.
Существует четыре основные типа точечных дефектов — вакансии, примесные атомы замещения и внедрения, дислоцированные атомы, дефекты Френкеля.
Вакансии (рис. 2.1, а) являются наиболее часто встречающимися точечными дефектами и представляют собой свободные узлы в кристаллической решетке.
Образованию вакансий, в первую очередь, способствуют тепловые колебания атомов. Вакансии возникают также при воздействии на металл механических напряжений, радиоактивного излучения и др. При образовании вакансий кристаллическая решетка искажается, и ближайшие к ней соседние атомы смещаются от своего равновесного положения. Например, для металлов с гранецентрированной кубической (ГЦК) решеткой такое смещение для ближайших соседних атомов составляет 0,84 % межатомного расстояния (в сторону вакансии), для второго слоя атомов — 0,25 % (в сторону от вакансии), для третьего слоя — 0,03 % (в сторону вакансии).
Технически чистые металлы, к которым относятся конструкционные материалы, всегда содержат в структуре примесные атомы внедрения и/или замещения (рис. 2.1, г), являющиеся дефектами не только физической, но и химической природы.
Примесные атомы замещения располагаются в узлах кристаллической решетки, замещая атомы основного металла. Примесные атомы внедрения располагаются в междоузлиях кристаллической решетки (рис. 2.1, г). При образовании сплавов атомы внедрения появляются в том случае, если отношение атомных диаметров растворенного и основного металлов не превышает 0,59.
К похожим дефектам относятся дислоцированные атомы (рис. 2.1, б) — атомы основного металла, смещенные из своих равновесных положений в междоузельные пространства. Преимущественными местами расположения дислоцированных атомов являются пустоты наибольшего объема, поскольку в этом случае искажения
решетки будут минимальны.
Образование вакансий и дислоцированных атомов может происходить одновременно. В этом случае образуются парные дефекты, называемые дефектами Френкеля (рис. 2.1 в). Энергия, необходимая для их образования, существенно выше, чем энергия, необходимая для образования индивидуальных вакансий или дислоцированных атомов, вследствие чего концентрация дефектов Френкеля в металлических материалах гораздо ниже, чем остальных точечных дефектов.
Точечные дефекты играют существенную роль в процессах диффузии ионов металла при образовании поверхностных оксидных пленок.
При легировании ионы легирующего компонента могут входить в решетку основного металла, образуя твердые растворы замещения или вытеснения.
Линейными (одномерными) дефектами кристаллической решетки являются дислокации. Дислокации возникают как в процессе затвердевания охлаждающегося металла, так и при механических или иных воздействиях на металл. В конструкционных материалах дислокации образуют сплошные сетки. В зависимости от условий изготовления металлических изделий плотность дислокаций в них может изменяться от 103-104 см~2 (в хорошо отожженных материалах) до 109-1010 см~2 (в пластически деформированных материалах). Средняя плотность дислокаций в поликристаллических материалах составляет 106-108см~2.
В реальных металлических материалах количество дислокаций таково, что они образуют сплошную трехмерную сетку с узлами, в которых происходит пересечение отдельных дислокаций. Расстояние между узлами сетки дислокаций оценивается как ~ 10~4 см.
К плоскостным и поверхностным дефектам кристаллической решетки (рис. 2.2 и 2.3) относятся границы, разделяющие различно ориентированные области — границы зерен (рис. 2.2, а, в, г), блоков (разориентированных под малыми углами областей одного зерна,рис. 2.3, б}, двойников (кристаллов, решетки которых являются зеркальным отражением друг друга, рис. 2.2, б}, а также границы, разделяющие участки решетки с различной упаковкой атомных слоев.
Типы границ различаются углом разориентировки 17 (рис. 2.3, а).Величина О для блоков обычно составляет 0,01 рад (~1°), для зерен эта величина может достигать десятков градусов. В этом случае границы представляют собой широкие полосы нарушения кристаллической структуры, обеспечивающие плавный переход от одной ориентации решетки к другой.
Чем больше величина П, тем выше энергия кристаллической решетки. Во всех
случаях энергия решетки, содержащей поверхностные дефекты, выше, чем содержащей линейные дефекты.
Граница, все атомы которой одновременно принадлежат обоим соприкасающимся кристаллам (зернам), называются когерентными(рис. 2.2, б\ в противном случае граница некогерентна.
Дефекты кристаллической решетки способствуют протеканию в металле процессов диффузии и фазовых превращений.
Так, например, хорошо известен вакансионный механизм диффузии, когда атомный механизм диффузии, когда атомы легирующих или примесных элементов перераспределяются в металле вследствие последовательного перемещения в вакантные узлы. Взаимодействие дефектов, приводящее к снижению энергии кристаллической решетки, является распространенным для металлических материалов явлением.
Основная часть металлических конструкционных материалов производится путем выплавки, технологии осуществления которой многоступенчаты и определяются требуемыми свойствами производимого материала. Общей чертой процессов выплавки металлов и сплавов является нагрев рудных материалов и полуфабрикатов до высоких
температур, превышающих температуру плавления наиболее тугоплавкого компонента, и последующее охлаждение до температуры затвердевания и далее до комнатной температуры.
Процесс затвердевания жидкого металла сопровождается изменением его агрегатного состояния с жидкого на твердое. Структура ближнего порядка, когда упорядоченное расположение атомов распространяется только на наиболее близких соседей (характерно для жидких тел или твердых тел, находящихся в аморфном состоянии),
изменяется при этом на структуру дальнего порядка, когда практически во всем объеме материала соблюдается регулярное расположение атомов (характерно для кристаллических твердых тел).
Объем тела при его затвердевании уменьшается на 2-6%, что является следствием уменьшения межатомных расстояний. Эффект тем больше, чем более компактная решетка характерна для затвердевшего металла.
Вследствие уменьшения объема металла при его затвердевании в структуре реального слитка, как правило, присутствуют макродефекты—трещины, раковины, полости. Кроме макродефектов затвердевший металл содержит большое количество микродефектов — вакансий, дислокаций, дефектов упаковки, границ раздела.
Любой вид неоднородности как то по составу, наличию примесей, очагов остаточного напряжения, электропроводности отдельных участков, приводит к увеличению скорости коррозии. Для того, чтобы устранить или уменьшить эти явления, проводят такие технологические операции как закалка, отжиг и др.
В подавляющем большинстве металлические конструкционные материалы являются многокомпонентными сплавами, в состав которых входят легирующие (вводимые специально для придания материалу необходимых свойств) и примесные (попадающие в материал с рудными материалами в процессе выплавки и металлургических переделов) элементы. Вступая друг с другом во взаимодействие компоненты сплавов могут образовывать фазы— однородные по структуре (кристаллическому строению) и составу (концентрации компонентов) области, ограниченные поверхностями раздела.
Конструкционные материалы, как правило, содержат несколько фаз, относительное количество которых может существенно различаться.
Фазы постоянного состава называют химическими соединениями или интерме-таллоидами.
Многие металлы испытывают аллотропическое превращение. Аллотропическим или полиморфным превращением называют изменение решетки кристаллического тела. Такое изменение происходит изотермически и характеризуется температурой фазового равновесия (То) двух аллотропических разновидностей. Например, железо при температурах до 910 °С и при 1401-1539°С образует α-фазу и кристаллизуется в виде кубической объемноцентрированной решетки, а в интервале температур 910-1401 °С образует γ-фазу в виде кубической гранецентрированной решетки.
В сплавах могут существовать твердые растворы. Твердые растворы называются непрерывными, если они образуются при любом соотношении компонентов.
Различают твердые растворы замещения и внедрения. В растворах замещения атомы компонентов могут замещать друг друга в любом узле решетки.
Дата добавления: 2015-11-04; просмотров: 3034;
