Способы выражения содержания растворенного вещества в растворе.
| Концентрация ратвора | Определение | Формула |
| Массовая доля (процентная концентрация) Массовое процентное содержание компонента, m% | Отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы. | 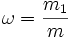 m1 — масса растворённого вещества, г (кг); m — общая масса раствора, г (кг).
m%=(mi/Σmi)*100
m1 — масса растворённого вещества, г (кг); m — общая масса раствора, г (кг).
m%=(mi/Σmi)*100
|
| Мольная доля | Отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. |
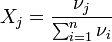 νi — количество i-го компонента, моль;
n — число компонентов;
νi — количество i-го компонента, моль;
n — число компонентов;
|
| Молярность (молярная объёмная концентрация) | Количество растворённого вещества (число молей) в единице объёма раствора. |
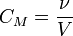 , моль/л
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Пример:
1,5 М раствор или CM=1,5 моль/л , моль/л
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Пример:
1,5 М раствор или CM=1,5 моль/л
|
| Моляльность (молярная весовая концентрация) | Количество растворённого вещества (число молей) в 1000 г растворителя. | 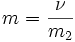 , моль/ кг
ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Пример:
m=1,5 моль/кг ( , моль/ кг
ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Пример:
m=1,5 моль/кг ( 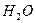 ) )
|
| Нормальная концентрация (мольная концентрация эквивалента, «нормальность») | Количество эквивалентов данного вещества в 1 литре раствора. | 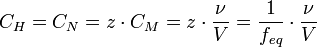 , моль/л
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число эквивалентности
(фактор эквивалентности
, моль/л
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число эквивалентности
(фактор эквивалентности 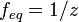 ). ).
|
6. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ХИМИЧЕСКАЯ КИНЕТИКА.
Учение о химических процессах базируется на:
1 – химической термодинамике
2 – химической кинетике.
Хими́ческая термодина́мика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики.
Основными направлениями химической термодинамики являются:
1. Классическая химическая термодинамика, изучающая термодинамическое равновесие вообще.
2. Термохимия, изучающая тепловые эффекты, сопровождающие химические реакции.
3. Теория растворов, моделирующую термодинамические свойства вещества исходя из представлений о молекулярном строении и данных о межмолекулярном взаимодействии.
Данные методические указания направлены на изучения возможностей управления физико-химическими процессами с помощью термодинамических методов. Для этой цели необходимо научиться:
1. рассчитывать энтропия, энтальпию и энергию Гиббса реакции
2. прогнозировать направления протекания процесса.
6.1. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТАЛЬПИЯ
Первое начало термодинамики (или первый закон термодинамики) является следствием закона сохранения энергии и устанавливает эквивалентность теплоты (обозначается Q или q) и энергии: количество теплоты Q, полученное системой, идёт на изменение её внутренней энергии U и совершение работы против внешних сил A.
Еще одна формулировка первого закона термодинамики связана с невозможностью создания вечного двигателя: невозможно создать вечный двигатель первого рода, который совершает работу без затрат энергии.
Математическое выражение этого закона для процессов, связанных с бесконечно малыми изменениями в системе, имеет вид:
d Q = dU + dA, (1.1)
где Q– теплота, U – внутренняя энергия, A – работа.
Это означает, что элементарное изменение внутренней энергии однозначно определяется конечным и начальным состояниями системы. Такие функции называют функциями состояния; к ним относятся внутренняя энергия U и энтальпия H, которая определяется следующим образом:
H = U + PV. (1.2)
Теплота и работа в общем виде не являются функциями состояния, они характеризуют не систему, а взаимодействие системы с окружающей средой. d является не полным дифференциалом, а частным, то есть бесконечно малым приращением. Однако в частных случаях теплота или работа могут быть равны изменению той или иной функции состояния:
Qv = DUv (V = const, T = const), (1.3)
Qp = DHp (P = const, T = const), (1.4)
где Т – температура, V – объем, P – давление системы. Подстрочный индекс у теплоты Qv(p) и функций состояния показывает условия протекания процесса.
Первый закон термодинамики широко применяется для расчета тепловых эффектов в химических реакциях.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — количество теплоты, выделившееся или поглощенное в результате реакции.Илиболее точно - отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Реакции, сопровождающиеся выделением теплоты в окружающую среду, называют экзотермическими. Для экзотермических реакций Q<0, DH <0, т.е. реакционная система в целом уменьшает свой запас энергии. Реакции, сопровождающиеся поглощением теплоты из окружающей среды, называют эндотермическими. Для эндотермических реакций Q>0, DH >0, т.е. реакционная система в целом увеличивает свой запас энергии.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
- Реакция должна протекать либо при постоянном объёме Qv (изохорный процесс), либо при постоянном давлении Qp (изобарный процесс).
- В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Раздел химии, посвященный количественному определению тепловых эффектов химических реакций, называется термохимией. Согласно закону Гесса (основному закону термохимии), тепловой эффект реакции не зависит от пути процесса, а определяется начальным и конечным состояниями системы, при условии, что объем и давление остаются постоянными, а температуры в конце и начале процесса равны.
Математически закон выражается уравнениями (1.3) – (1.4) для изохорного и изобарного процесса.
Для расчета тепловых эффектов составляют термохимические уравнения, в которых рядом с символом химического соединения указывают агрегатное состояние (г – газ, ж – жидкость, т – твердое, aq – соединение или ион в растворе) и в правой части – численное значение теплового эффекта.
Например:
Mn(т) + 2Н+(aq) = Mn2+(aq) + H2(г) - 227,7 кДж.
Если реакция задана в общем виде:
aA + bB = cC + dD + DH, (1.5)
то тепловой эффект реакции можно определить по следующей формуле:
DH = cDHС + dDHD - aDHA - bDHB =
= 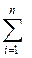 (DHini)прод. -
(DHini)прод. - 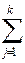 (DHjnj)исх. (1.6)
(DHjnj)исх. (1.6)
где DНi – теплота образования вещества i; DНj – теплота образования вещества j; a, b, n – стехиометрические коэффициенты в термохимическом уравнении.
Если реакцию проводят при стандартных условиях при Т = 298 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHr0. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Теплота (энтальпия) образования - тепловой эффект образования данного соединения из простых веществ в стабильном состоянии (теплота образования простых веществ принята равной нулю). Теплоты образования, определенные при стандартных условиях в расчете на 1 моль, приведены в термохимических справочниках .
6.2. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ
Второе начало термодинамики (или 2-й закон термодинамики) исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии.
2 — Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
Более простые формулировки второго закона термодинамики следующие:
Дата добавления: 2015-10-26; просмотров: 1360;
