Лабораторные работы
1.3.1 Взвешивание . Определение воды в кристаллогидрате
Приборы и материалы: технохимические весы, аналитические весы, разновесы, пинцет, фарфоровый тигель, кристаллогидрат, муфельная печь, концентрированная серная кислота.
Правила взвешивания на весах:
1. Нельзя переносить весы с одного места на другое. Следить за исправ-ностью и чистотой весов. Не допускать взвешивания на весах грязных, мокрых и горячих предметов.
2. Обращаться с весами надо осторожно и аккуратно. Взвешивая, сидеть перед весами, а не сбоку.
3. Нельзя класть взвешиваемое вещество или предмет непосредственно на чашку весов. Химические вещества взвешивать на часовом стекле, в бюксе или на бумаге.
4. Нагружать и разгружать весы можно только при выключенном арретире. Включать и выключать арретир следует медленно, без рывков во избежание резкого падения призм на рабочие поверхности.
5. При выполнении определённой работы надо пользоваться одними и теми же весами и разновесами. Брать разновесы только пинцетом.
6. Взвешиваемый предмет класть на левую чашку весов, а разновесы - на правую.
7. Результаты взвешивания записывать по пустым гнёздам в разновесе и проверять затем при установке разновесок по местам.
8. Окончив взвешивание, необходимо опустить арретир и разгрузить весы.
Ход работы
1. Получите у лаборанта пронумерованные предметы и взвесьте их на технохимических и аналитических весах. Значение масс предметов запишите в лабораторном журнале (таблице), проверьте у преподавателя правильность полученных результатов. Для выполнения практических работ по общей химии обычно вполне достаточно взвешивать с точностью до 0,02 г. Для этого удобнее всего пользоваться технохимическими весами. Если по ходу работы необходимо определить массу вещества с точностью до 0,0002 г, то нужно пользоваться аналитическими весами. Проведите математическую обработку полученных данных и рассчитайте ошибки взвешивания. Результаты запишите в таблицу.
2. Взвесьте сухой, заранее прокаленный фарфоровый тигель. В тигель внесите 2 г кристаллогидрата, взвесьте тигель с кристаллогидратом, а затем прокалите его в муфельной печи при температуре несколько большей, чем температура разложения кристаллогидрата (по данным справочника). Потом охладите тигель в эксикаторе с Н2SО4 (конц.).
3. взвесьте остывший тигель. Снова поместите тигель в печь, прокалите 20-30 мин, остудите в эксикаторе и взвесьте. Если результат второго взвешивания совпадает (с точностью до 0,01 г) с данными первого взвешивания, то можно считать, что обезвоживание завершено. По результатам взвешивания рассчитайте количество воды в кристаллогидрате, которое приходится на 1 моль безводной соли.
4. Запишите полученные данные и результаты. Рассчитайте ошибку эксперимента;
масса пустого тигля - m1, г
масса тигля с навеской - m2, г
масса кристаллогидрата - m3, г
масса тигля с обезвоженным веществом - m4, г
масса безводной соли - m5, г
содержание воды в кристаллогидрате - m, г
число молей Н2О, которое приходится на 1 моль соли - n
Абсолютная и относительная ошибки
Абсолютная ошибка ± L при определении массы представляет собой разность между истинной массой В и массой Е, полученной опытным путем: ± (В – Е).
На практике чаще вычисляется относительная ошибка, выражаемая в процентах, которая представляет собой отношение абсолютной ошибки к истинному значению, умноженное на 100:
L % = 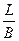 100 %.
100 %.
1.3.2 Очистка веществ
Очистка бихромата калия (K2Cr2O7)
1. Вычислите, какое количество бихромата калия необходимо взять, чтобы получить насыщенный при 60 0С раствор, исходя из объема воды 50 мл. Навеску рассчитанного количества бихромата калия, предварительно измельченного в ступке, высыпьте в термостойкий химический стакан вместимостью 100-200 мл, влейте 50 мл дистиллированной воды. Стакан с содержимым поставьте на асбестовую сетку и нагрейте до растворения навески, помешивая раствор стеклянной палочкой. Далее раствор отфильтруйте в стакан через складчатый фильтр. Фильтрование проводите быстро во избежание потерь преждевременной кристаллизации. Фильтрат охладите, постоянно перемешивая стеклянной палочкой. Наблюдается ли изменение окраски раствора и почему? Выпавшие кристаллы отфильтруйте на воронке Бюхнера и промойте 1-2 мл ледяной воды. Полученные кристаллы высушите между листами фильтровальной бумаги, а затем в сушильном шкафу при 100 0С в течение 30-40 мин (до постоянного веса). Кристаллы взвесьте и рассчитайте выход очищенного бихромата калия (%).
2. Исследуйте маточный раствор на присутствие примеси сульфат-иона. Для этого к 2-3 мл разбавленного до 5-10 мл дистиллированной водой раствора добавьте 1-2 капли концентрированного раствора хлористого бария. Что наблюдается? Аналогично определите, присутствуют ли сульфат-ионы в кристаллах бихромата. В виде какой примеси находятся сульфат-ионы?
Для проверки чистоты полученного вещества определите температуру плавления кристаллов в приборе. Для этого кристаллы разотрите в ступке в тонкий порошок и заполните ими капиллярную трубку на высоту 2-3 мм. Капиллярная трубка с запаянным концом должна иметь длину 6-8 см и диаметр 0,5 мм. Для её наполнения открытый конец погрузить в измельченное вещество, затем перевернуть, легким постукиванием о деревянную поверхность пересыпать вещество в нижний запаянный конец трубки и уплотнить. Операцию повторить несколько раз. Заполненную капиллярную трубку прикрепить к термометру резиновым кольцом небольшого диаметра так, чтобы нижний конец трубки и шарик термометра находились на одном уровне. Термометр с капилляром поместить в колбу с удлиненным горлом, наполненную глицерином, парафином, вазелиновым маслом или пустую. Колбу нагреть так, чтобы температура поднималась на 2-3 градуса за 1 мин. Температуру плавления сравнить со справочными данными и вычислить ошибку. Исходную соль необходимо взять в количестве на 10% больше вычисленного, т.к. исходный продукт загрязнен примесями (песком, кусочками угля, сульфатами, хлоридами). Все операции по перекристаллизации выполняются как в пункте 1. Температурный интервал для расчета – 70 0С. Охладите фильтрат в ледяной воде до 0-5 0С.
Очистка хлорида натрия
1. Приготовьте насыщенный раствор поваренной соли при комнатной температуре, растворив 20 г её в 50 мл воды. Раствор отфильтруйте в стаканчик. Соберите прибор под тягой. В круглодонную колбу поместите 10 г хлорида натрия и через воронку добавьте 20-25 мл 70-% серной кислоты. Содержимое колбы нагрейте через асбестовую сетку. Запишите наблюдения и уравнения реакции.
2. Пропустите ток хлористого водорода в приготовленный насыщенный раствор хлорида натрия (стаканчик). После насыщения раствора (как это определить?) прекратите пропускание хлороводорода, а полученные кристаллы отфильтруйте, высушите в сушильном шкафу, взвесьте и рассчитайте выход. Объясните механизм этого варианта очистки перекристаллизацией.
Очистка воды дистилляцией
Соберите прибор для перегонки воды. В колбу налейте раствор медного купороса и поместите в нее длинные капиллярные трубки (для чего?), заполните холодильник водой (ток воды подается снизу вверх). Приемник закройте пробкой, снабженной аллонжем и хлоркальциевой трубкой с натронной известью (с какой целью?). Закройте колбу пробкой с термометром, нагрейте раствор до кипения и отгоните 10-15 мл воды. Чистая вода получается или нет?
Как проверить, не содержит ли вода сернокислую медь? На часовое стекло налейте несколько капель очищенной воды и выпарьте. На другом часовом стекле проделайте то же самое с водопроводной водой. Сравните результаты.
Очистка диоксида углерода
Познакомьтесь с устройством аппарата Киппа и зарядите его для получения углекислого газа. Вынув пробку с краном, загрузите средний шар мрамором. Закройте отверстие среднего резервуара пробкой с газоотводной трубкой и откройте кран. В верхний шар налейте такое количество 20% раствора HCl, чтобы он, заполнив часть аппарата Киппа, покрыл часть мрамора, находящегося в среднем резервуаре, после этого закройте кран. Что наблюдается? Написать уравнение реакции, протекающей в аппарате Киппа.
Чем может быть загрязнен газ? В течение 5-10 мин пропустите слабый ток углекислого газа в колбу. Исследуйте содержание колбы на присутствие HCl. Далее присоедините к аппарату Киппа хлоркальциевую трубку, содержащую обезвоженную сернокислую медь. Пропустите через нее ток углекислого газа. Что наблюдается? О чем говорят эти опыты? Как получить чистый углекислый газ? Газоотводную трубку прибора соедините с капиллярной пипеткой и конец её опустите в коническую колбу, пред-варительно заполненную дистиллированной водой.
Очистка йода возгонкой
Поместите на дно стакана для возгонки 0,3 г кристаллического йода и 0,1 г йодистого калия (зачем он добавляется?). Накройте стакан кругло-донной колбой, заполненной холодной водой, осторожно нагрейте пламенем горелки через асбестовую сетку. Наблюдается ли образование жидкости при возгонке? Кристаллы йода соберите на часовое стекло или в бюкс и опре-делите выход йода в процентах.
Контрольные вопросы
1. Что такое кристаллогидраты? Приведите примеры.
2. Почему диоксид углерода, получающийся в аппарате Киппа, промы-вают сначала раствором гидрокарбоната натрия, а потом серной кислотой ?
3. Как правильно записать точную массу предметов, взвешенных: а) на технохимических весах; б) на аналитических весах.
4. Что означает «довести до постоянной массы»?
5. Опишите правила взвешивания на различных типах весов. Как правильно пользоваться разновесами?
Дата добавления: 2015-10-21; просмотров: 1018;
