Устойчивость коллоидных систем
Наличие у коллоидных частиц одноименных электрических зарядов вызывает их взаимное отталкивание и тем самым препятствует объединению коллоидных частиц и росту кристаллов. Способность коллоидной системы сохранять первоначальную дисперсность называется агрегативной устойчивостью.
Агрегативная устойчивость обусловлена наличием в системе ионного стабилизатора – электролита, взятого в избытке при получении коллоидного раствора. Адсорбция ионов стабилизатора приводит к появлению на коллоидных частицах зарядов одного знака, препятствующих слипанию частиц при их столкновении. Наличие гидратных оболочек у частиц дисперсной фазы также повышает агрегативную устойчивость.
Уменьшение абсолютной величины заряда коллоидных частиц приведет к потере агрегативной устойчивости и при столкновениях частицы будут слипаться и укрупняться. Такой процесс называется коагуляцией.
Укрупнение частиц в результате коагуляции приводит к нарушению седиментационной устойчивости – способности системы противостоять силе тяжести. Достигнув определенной величины, коллоидные частицы уже не способны удерживаться во взвешенном состоянии и оседают под действием силы тяжести. Этот процесс называется седиментацией.
Коагуляция, может быть вызвана самыми разнообразными причинами и, прежде всего, добавкой электролита. При этом существует ряд общих правил:
1. Коагулирующим действием обладает не весь электролит, а только тот ион, который имеет заряд, противоположный заряду коллоидной частицы. Он называется ионом-коагулятором.
2. Минимальная концентрация электролита, вызывающая коагуляцию золя, называется порогом коагуляции 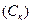 :
:
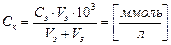 ,
,
где 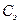 — молярная концентрация электролита, моль/л;
— молярная концентрация электролита, моль/л;
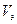 - объем электролита, л;
- объем электролита, л;
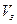 - объем золя, л.
- объем золя, л.
3. Величина, обратная порогу коагуляции, называется коагулирующей способностью 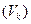 :
:
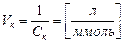 .
.
Коагулирующая способность иона тем больше, чем выше его заряд. Эмпирически установлено, что порог коагуляции обратно пропорционален шестой степени заряда 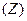 иона - коагулятора (правило Шульце-Гарди):
иона - коагулятора (правило Шульце-Гарди):
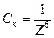 .
.
Значения порогов коагуляции для одно-, двух- и трехзарядных ионов относятся как числа 729 : 11 : 1.
Дата добавления: 2015-10-19; просмотров: 1262;
