Задача 4
4.1. Какой объём 3,3 н. раствора сульфата никеля 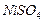 (
(  1,19 г/мл) следует добавить к 200 мл 0,66 М раствора (
1,19 г/мл) следует добавить к 200 мл 0,66 М раствора (  1,08 г/мл), чтобы получить 12 %-й (по массе) раствор
1,08 г/мл), чтобы получить 12 %-й (по массе) раствор 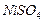 (
(  1,12 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,12 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.2. Какой объём 0,51 М раствора (  1,02 г/мл) гидроксида натрия необходимо взять, чтобы при добавлении к нему 16,5 г твёрдого
1,02 г/мл) гидроксида натрия необходимо взять, чтобы при добавлении к нему 16,5 г твёрдого 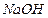 массовая доля гидроксида натрия возросла до
массовая доля гидроксида натрия возросла до
11 %? Для полученного раствора (  1,12 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,12 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.3. К 1149 мл 2,87 М раствора соляной кислоты 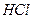 (
(  1,047 г/мл) прилили 1047 мл 9,44 М раствора
1,047 г/мл) прилили 1047 мл 9,44 М раствора 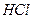 (
( 
1,149 г/мл). Для полученного раствора (  1,1 г/мл) рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,1 г/мл) рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.4. В лаборатории имеются: 60 %-й (по массе) раствор (  1,5 г/мл) и 30 %-й (по массе) раствор (
1,5 г/мл) и 30 %-й (по массе) раствор (  1,2 г/мл) серной кислоты
1,2 г/мл) серной кислоты 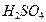 . Какой объём каждого раствора нужно взять, чтобы при их смешении получить 240 г раствора с массовой долей
. Какой объём каждого раствора нужно взять, чтобы при их смешении получить 240 г раствора с массовой долей 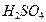 0,5 (
0,5 (  1,4 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,4 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.5. При охлаждении насыщенного при 100 °С раствора дихромата калия 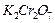 до 20 °С выкристаллизовалось 100 г
до 20 °С выкристаллизовалось 100 г 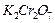 , и получился раствор (
, и получился раствор (  1,068 г/мл) объёмом 264 мл, массовая доля
1,068 г/мл) объёмом 264 мл, массовая доля 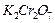 в котором составляет 0,1. Определите растворимость
в котором составляет 0,1. Определите растворимость 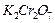 при 100 °С (в граммах на 100 г воды). Рассчитайте для полученного после охлаждения раствора: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
при 100 °С (в граммах на 100 г воды). Рассчитайте для полученного после охлаждения раствора: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.6. Какой объём раствора бромида цинка (  1,2 г/мл), титр которого равен 0,24 г/мл, необходимо добавить к 400 мл 0,56 н. раствора
1,2 г/мл), титр которого равен 0,24 г/мл, необходимо добавить к 400 мл 0,56 н. раствора 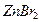 (
(  1,05 г/мл), чтобы массовая доля бромида цинка в растворе стала равной 10 %? Для полученного раствора (
1,05 г/мл), чтобы массовая доля бромида цинка в растворе стала равной 10 %? Для полученного раствора (  1,10 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,10 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.7. Какой объём 0,5 н. раствора оксалата натрия 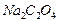 (
(  1,03 г/мл) необходимо взять, чтобы при добавлении к нему 7,07 г
1,03 г/мл) необходимо взять, чтобы при добавлении к нему 7,07 г 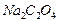 титр стал равным 0,108 г/мл? Для полученного раствора (
титр стал равным 0,108 г/мл? Для полученного раствора (  1,08 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю
1,08 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю 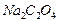 , титр.
, титр.
4.8. Смешали два раствора сульфата кадмия 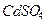 : 500 мл 25 %-го (по массе) (
: 500 мл 25 %-го (по массе) (  1,289 г/мл) и 550 мл 40 %-го (по массе) (
1,289 г/мл) и 550 мл 40 %-го (по массе) (  1,574 г/мл). Для полученного раствора (
1,574 г/мл). Для полученного раствора (  1,430 г/мл) рассчитайте: массовую долю
1,430 г/мл) рассчитайте: массовую долю 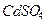 , молярную концентрацию, моляльную концентрацию, титр.
, молярную концентрацию, моляльную концентрацию, титр.
4.9. В лаборатории имеются растворы красной кровяной соли, титр 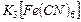 в которых составляет 0,041 г/мл (
в которых составляет 0,041 г/мл (  1,02 г/мл) и 0,151 г/мл (
1,02 г/мл) и 0,151 г/мл (  1,08 г/мл). Какие объёмы растворов необходимо смешать, чтобы получился раствор объёмом 200 мл с массовой долей
1,08 г/мл). Какие объёмы растворов необходимо смешать, чтобы получился раствор объёмом 200 мл с массовой долей 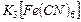 0,1 и плотностью
0,1 и плотностью  1,05 г/мл? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,05 г/мл? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.10. При охлаждении 2,4 кг насыщенного при 45 °С раствора бромида калия 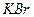 (
(  1,4 г/мл) выделилось 400 г твёрдого
1,4 г/мл) выделилось 400 г твёрдого 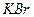 и получился раствор, в котором на 100 г воды приходится
и получился раствор, в котором на 100 г воды приходится
50 г 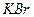 . Рассчитайте для исходного раствора: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю
. Рассчитайте для исходного раствора: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю 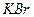 ,титр.
,титр.
4.11. Какой объём раствора вольфрамата натрия ( 
1,1 г/мл), титр 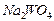 в котором равен 0,11 г/мл, необходимо взять, чтобы при добавлении к нему 30 г
в котором равен 0,11 г/мл, необходимо взять, чтобы при добавлении к нему 30 г 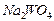 молярная концентрация стала равной 0,63 моль/л? Для полученного раствора (
молярная концентрация стала равной 0,63 моль/л? Для полученного раствора (  1,16 г/мл) рассчитайте: массовую долю
1,16 г/мл) рассчитайте: массовую долю 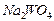 , молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.12. В лаборатории имеются 0,84 н. (  1,08 г/мл) и 1,82 н. (
1,08 г/мл) и 1,82 н. (  1,16 г/мл) растворы ацетата бария
1,16 г/мл) растворы ацетата бария 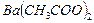 . Какой объём каждого раствора нужно взять, чтобы после их смешения получить 250 мл 14 %-го (по массе) раствора
. Какой объём каждого раствора нужно взять, чтобы после их смешения получить 250 мл 14 %-го (по массе) раствора 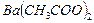 (
(  1,1 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,1 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.13. К 577 мл 0,51 М раствора (  1,04 г/мл) перхлората натрия
1,04 г/мл) перхлората натрия 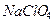 прилили 336 мл раствора (
прилили 336 мл раствора (  1,19 г/мл), титр
1,19 г/мл), титр 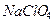 в котором равен 0,3094 г/мл. Для полученного раствора (
в котором равен 0,3094 г/мл. Для полученного раствора (  1,09 г/мл) рассчитайте: массовую долю
1,09 г/мл) рассчитайте: массовую долю 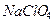 , молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.14. При упаривании 1,76 М раствора (  1,1 г/мл) хлорной кислоты
1,1 г/мл) хлорной кислоты 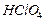 из него испарилось 3,35 моль воды и получился
из него испарилось 3,35 моль воды и получился
2 М раствор (  1,113 г/мл). Определите для исходного раствора: объём, молярную концентрацию эквивалентов, массовую долю
1,113 г/мл). Определите для исходного раствора: объём, молярную концентрацию эквивалентов, массовую долю 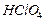 , моляльную концентрацию, титр.
, моляльную концентрацию, титр.
4.15. Какой объём 1,3 М раствора молибдата натрия 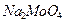 (
(  1,217 г/мл) нужно добавить к 150 мл 8 %-го (по массе) раствора
1,217 г/мл) нужно добавить к 150 мл 8 %-го (по массе) раствора 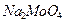 (
(  1,071 г/мл), чтобы получить раствор, титр
1,071 г/мл), чтобы получить раствор, титр 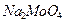 в котором равен 0,184 г/мл? Для полученного раствора (
в котором равен 0,184 г/мл? Для полученного раствора (  1,15 г/мл) рассчитайте: массовую долю
1,15 г/мл) рассчитайте: массовую долю 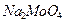 , молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию.
, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию.
4.16. Какой объём 1 %-го (по массе) раствора силиката натрия 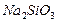 (
(  1,007 г/мл) необходимо взять, чтобы при добавлении к нему 1,7 г
1,007 г/мл) необходимо взять, чтобы при добавлении к нему 1,7 г 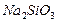 получился раствор, моляльность которого равна 0,167 моль/кг
получился раствор, моляльность которого равна 0,167 моль/кг 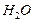 ? Для полученного раствора (
? Для полученного раствора (  1,015 г/мл) рассчитайте: массовую долю
1,015 г/мл) рассчитайте: массовую долю 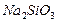 , молярную концентрацию, молярную концентрацию эквивалентов, титр.
, молярную концентрацию, молярную концентрацию эквивалентов, титр.
4.17. В лаборатории имеются 20 %-й (по массе) (  1,16 г/мл) и 12 %-й (по массе) (
1,16 г/мл) и 12 %-й (по массе) (  1,1 г/мл) растворы нитрата кальция
1,1 г/мл) растворы нитрата кальция 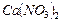 . Какие объёмы растворов необходимо взять, чтобы после их смешивания получить 100 мл 2,2 н. раствора
. Какие объёмы растворов необходимо взять, чтобы после их смешивания получить 100 мл 2,2 н. раствора 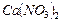 ? Для полученного раствора (
? Для полученного раствора (  1,13 г/мл) рассчитайте: массовую долю
1,13 г/мл) рассчитайте: массовую долю 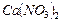 , молярную концентрацию, моляльную концентрацию, титр.
, молярную концентрацию, моляльную концентрацию, титр.
4.18. При упаривании 8 %-го (по массе) раствора ( 
1,067 г/мл) хлорида железа (III) испарилось 53,5 г воды и получился 2 н. раствор (  1,085 г/мл). Определите объём исходного раствора. Для раствора, полученного после упаривания, рассчитайте: массовую долю
1,085 г/мл). Определите объём исходного раствора. Для раствора, полученного после упаривания, рассчитайте: массовую долю 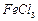 , молярную концентрацию, моляльную концентрацию, титр.
, молярную концентрацию, моляльную концентрацию, титр.
4.19. К 195 мл 4 %-го (по массе) раствора хлорида натрия (  1,026 г/мл) прибавили 428 мл 1,83 М раствора (
1,026 г/мл) прибавили 428 мл 1,83 М раствора ( 
1,070 г/мл). Для полученного раствора (  1,056 г/мл), рассчитайте: массовую долю
1,056 г/мл), рассчитайте: массовую долю 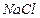 ,молярную концентрацию, молярную концентрацию эквивалентов.
,молярную концентрацию, молярную концентрацию эквивалентов.
4.20. Какой объём 20 %-го (по массе) раствора гидроксида калия 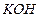 (
(  1,176 г/мл) необходимо добавить к 100 мл 50 %-го (по массе) раствора (
1,176 г/мл) необходимо добавить к 100 мл 50 %-го (по массе) раствора (  1,525 г/мл)
1,525 г/мл) 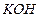 , чтобы получить раствор с массовой долей гидроксида калия 0,25 (
, чтобы получить раствор с массовой долей гидроксида калия 0,25 (  1,229 г/мл). Для полученного раствора рассчитайте: моляльную концентрацию, молярную концентрацию, молярную концентрацию эквивалентов, титр.
1,229 г/мл). Для полученного раствора рассчитайте: моляльную концентрацию, молярную концентрацию, молярную концентрацию эквивалентов, титр.
4.21. При охлаждении насыщенного при 80 °С раствора (  1,30 г/мл) нитрата аммония
1,30 г/мл) нитрата аммония 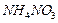 выделилось 1,5 моль нитрата аммония и получился раствор (
выделилось 1,5 моль нитрата аммония и получился раствор (  1,34 г/мл) объёмом
1,34 г/мл) объёмом
70 мл, в котором на 100 г воды приходится 192 г 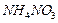 . Определите растворимость нитрата аммония в воде при 80 °С (в массовых долях). Для полученного, после охлаждения, раствора рассчитайте: массовую долю
. Определите растворимость нитрата аммония в воде при 80 °С (в массовых долях). Для полученного, после охлаждения, раствора рассчитайте: массовую долю 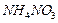 , молярную концентрацию, титр, моляльную концентрацию.
, молярную концентрацию, титр, моляльную концентрацию.
4.22. Смешали 100 мл 2,6 н. раствора (  1,04 г/мл) и 80 мл 30 %-го раствора (
1,04 г/мл) и 80 мл 30 %-го раствора (  1,1 г/мл) карбоната аммония
1,1 г/мл) карбоната аммония 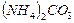 . Для полученного раствора (
. Для полученного раствора (  1,07 г/мл) рассчитайте: массовую долю
1,07 г/мл) рассчитайте: массовую долю 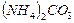 , молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.23. Какой объём 6 %-го (по массе) раствора (  1,015 г/мл) нитрата серебра
1,015 г/мл) нитрата серебра 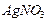 необходимо взять, чтобы при добавлению к нему 1,9 г
необходимо взять, чтобы при добавлению к нему 1,9 г 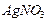 молярная концентрация стала бы равной 0,37 моль/л? Для полученного раствора (
молярная концентрация стала бы равной 0,37 моль/л? Для полученного раствора (  1,05 г/мл) рассчитайте: массовую долю AgNO3, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,05 г/мл) рассчитайте: массовую долю AgNO3, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.24. Какой объём 30%-го (по массе) раствора соляной кислоты 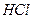 (
(  1,149 г/мл) нужно добавить к 5 л 0,5 М раствора
1,149 г/мл) нужно добавить к 5 л 0,5 М раствора 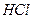 (
(  1,007 г/мл), чтобы получить одномолярный раствор соляной кислоты? Для полученного раствора (
1,007 г/мл), чтобы получить одномолярный раствор соляной кислоты? Для полученного раствора (  1,016 г/мл) рассчитайте: массовую долю
1,016 г/мл) рассчитайте: массовую долю 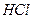 , молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.25. В лаборатории имеются 1,2 М (  1,01 г/мл) и 9,8 М (
1,01 г/мл) и 9,8 М (  1,11 г/мл) растворы пероксида водорода
1,11 г/мл) растворы пероксида водорода 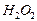 . Какие объёмы растворов необходимо взять, чтобы при их смешении получилось 250 г раствора, титр которого равен 0,104 г/мл? Для полученного раствора (
. Какие объёмы растворов необходимо взять, чтобы при их смешении получилось 250 г раствора, титр которого равен 0,104 г/мл? Для полученного раствора (  1,04 г/мл) рассчитайте: массовую долю
1,04 г/мл) рассчитайте: массовую долю 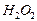 , молярную концентрацию, моляльную концентрацию, мольную долю H2O2.
, молярную концентрацию, моляльную концентрацию, мольную долю H2O2.
Дата добавления: 2015-10-19; просмотров: 1245;
