Осмос. Осмотическое давление
Осмосом называют процесс односторонней диффузии растворителя через полупроницаемую перегородку (мембрану) из чистого растворителя в раствор или из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентрацией.
Если мембрана (например, целлофан) разделяет раствор и чистый растворитель и может пропускать молекулы воды (растворителя), но не пропускает молекулы растворенного вещества, то оказывается, что скорость диффузии молекул воды через перегородку в разных направлениях будет различна. Она будет выше для потока молекул, диффундирующих из растворителя в раствор. Объём раствора при этом будет постепенно увеличиваться, а объём растворителя будет соответственно уменьшаться.
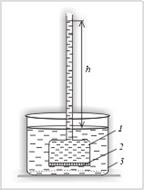
Рис. 1. Прибор для определения осмотического давления: 1 – сосуд с раствором; 2 – полупроницаемая перегородка; 3 – сосуд с растворителем
Если сосуд 1, закрытый внизу полупроницаемой перегородкой 2 и наполненный водным раствором какого-либо вещества, поместить в сосуд 3 с водой, то вода будет проходить из сосуда 3 в со-
суд 1 (рис. 1). Через некоторое время объем раствора в сосуде 1 увеличится и его уровень поднимется выше уровня растворителя в сосуде 3 на высоту 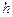 . В результате увеличения объема раствора в сосуде 1 возникает гидростатическое давление, называемое осмотическим давлением, которое количественно оценивается высотой
. В результате увеличения объема раствора в сосуде 1 возникает гидростатическое давление, называемое осмотическим давлением, которое количественно оценивается высотой 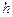 подъема жидкости в сосуде 1.
подъема жидкости в сосуде 1.
Осмотическое давление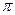 – это гидростатическое давление столба жидкости высотой
– это гидростатическое давление столба жидкости высотой 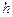 , от которого осмос прекращается.
, от которого осмос прекращается.
Осмотическое давление в разбавленных растворах зависит от концентрации растворенного вещества и температуры и не зависит от природы растворителя и растворённых веществ. Эта зависимость выражается уравнением Вант-Гоффа, аналогичным уравнению Менделеева-Клапейрона для газов:
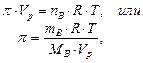
где 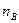 - количество растворенного вещества, моль;
- количество растворенного вещества, моль;
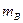 - масса растворенного вещества, г;
- масса растворенного вещества, г;
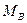 - молярная масса растворенного вещества, г/моль;
- молярная масса растворенного вещества, г/моль;
 - объём раствора, м3;
- объём раствора, м3;
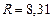 Дж/моль·К;
Дж/моль·К;
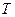 - температура, К;
- температура, К;
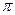 - осмотическое давление, Па.
- осмотическое давление, Па.
При выражении объёма в литрах уравнение примет следующий вид:
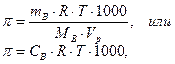
где 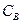 - молярная концентрация вещества в растворе, моль/л.
- молярная концентрация вещества в растворе, моль/л.
Если растворы характеризуются одинаковыми осмотическими давлениями, то, по Вант-Гоффу, такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
По значению осмотического давления раствора определяют молекулярные массы растворенных веществ. Этот метод приме-
ним даже для разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Из уравнения Вант-Гоффа получается уравнение, позволяющее вычислять молекулярные массы растворенных веществ:
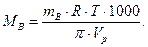
Пример 11. Вычислите осмотическое давление раствора сахара 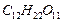 , если 200 мл раствора содержит 13 г растворенного вещества при температуре 17 °С.
, если 200 мл раствора содержит 13 г растворенного вещества при температуре 17 °С.
Решение: Воспользуемся формулой
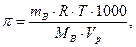
подставим в нее соответствующие значения и получим:
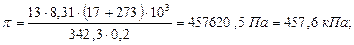
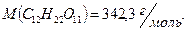
Пример 12. Осмотическое давление раствора, содержащего в 1 л 72 г маннита, равно 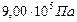 при 0 °С. Определите формулу маннита, если известно, что вещество содержит 39,56 % углерода, 7,69 % водорода и 52,75 % кислорода.
при 0 °С. Определите формулу маннита, если известно, что вещество содержит 39,56 % углерода, 7,69 % водорода и 52,75 % кислорода.
Решение: Найдем молярную массу маннита из формулы
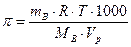
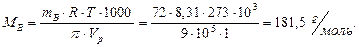
Найдем простейшую формулу маннита, обозначив число атомов  в молекуле данного соединения соответственно
в молекуле данного соединения соответственно 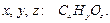
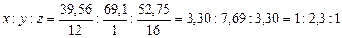 .
.
Простейшая формула 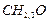 . Этой формуле соответствует молекулярная масса, равная
. Этой формуле соответствует молекулярная масса, равная 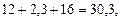 что отличается от найденного выше значения в 6 раз:
что отличается от найденного выше значения в 6 раз:  . Следовательно, истинная формула будет
. Следовательно, истинная формула будет 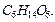
Дата добавления: 2015-10-19; просмотров: 2707;
