Строение миофибрилл.
Сократительные элементы – миофибриллы – занимают большую часть объема миоцитов. В нетренированных мышцах миофибриллы расположены, рассеяно, а тренированных они сгруппированы в пучки, называемые полями Конгейма.
Микроскопическое изучение строения миофибрилл показало, что они имеют диаметр около 1 мкм и состоят из чередующихся светлых и темных участков или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчертанность всего мышечного волокна.
Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными в свою очередь, из большого числа мышечных нитей дух типов – толстых и тонких.Толстые в два раза толще тонких, соответственно 15 и 7 нм.
Состоят миофибриллы из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг на друга.
Участок миофибриллы, состоящий из толстых нитей и находящимися между ними концов тонких нитей, обладает двойным лучепреломлением. Под микроскопом эти участки кажутся темными и получили название анизотропных или темных дисков (А-диски).
Тонкие участки состоят из тонких нитей и выглядят светлыми, так как не обладают двойным лучепреломлением и легко пропускают свет. Такие участки называются изотропными или светлыми дисками (I-диски).
Z Z Z
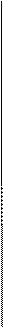
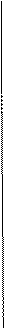
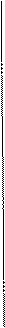


 — — — —
— — — —


 — — — —
— — — —


 — — — —
— — — —





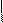 I-диск А-диск
I-диск А-диск
Рисунок. Схема строения миофибриллы
В середине пучка тонких нитей (диск I) поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Эта пластинка хорошо видна под микроскопом и названа Z-пластинкой или Z-линией.
Диски А имеют в середине более светлую полосу – зону Н, пересекаемую более темной М – зоной.
Участок между соседними Z-линиями называется саркомер.Каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000-1200).
саркомер
а 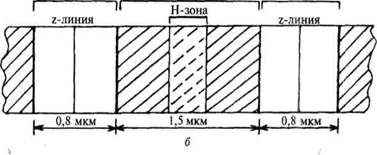
I-диск А-диск I-диск
Рисунок. Структура мышцы на разных уровнях организации: а –мышечное волокно; б – расположение миофибриллы в покоящейся мышце
Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплаз-матический ретикулум, составляющий 8—10% объема клетки; 3) несколько митохондрий. Длина саркомера обусловлена генетически и в ходе спортивной тренировки любой направленности не изменяется.
Диски I состоят только из тонких филаментов, а диски А – из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм; расстояние между этими мостиками 40 нм.
Изучение химического состава миофибрилл показало, что тонкие и толстые нити образованы белками. Палочковидная молекула миозина состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа.
Толстые нити (микрофиламенты) состоят из белка миозина.Эти белки образуют двойную спираль с глобулярной головкой на конце, присоединенной к очень длинному стержню. Стержень представляет собой двухцепочечную а-спирализованную суперспираль.
Миозиновые головки обладают АТФазной активностью, то есть способностью расщеплять АТФ. Второй участок миозина обеспечивает связь толстых нитей с тонкими. Общая структура миозина показана на рисунке.
хвост 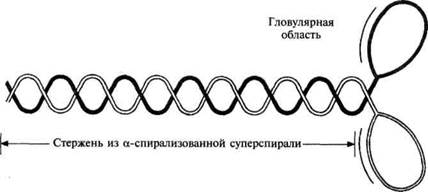
Рисунок. Схематичное изображение молекулы миозина
Тонкие нити состоят из белков актина, тропонина и тропомиозина.
Основной белок в данном случае актин. Он обладает двумя важнейшими свойствами:
- образует фибриллярный актин, способный к быстрой полимеризации;
- актин способен соединяться с миозиновыми головками поперечными мостиками.
Актин–водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G-актин. В мышечном волокне актин находится в полимеризованной форме, которая обозначается как F-актин. Тонкие филаменты мышцы образованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями.
Другие белки тонких нитей помогают актину осуществлять его функции.
Тропонин(Тн), молекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функциями: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-1) и кальцийсвязывающей (Тн-С). Каждый компонент тонких филаментов соединяется с двумя другими нековалентными связями:
F-актин — тропомиозин
Тн-1 Тн-Т
В мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис.), тропомиозин блокирует присоединение миозиновой головки к находящемуся рядом молекулами глобулярного актина тонких нитей (F-актину).
Молекулы миозина объединяются, образуя филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии 14,3 нм друг от друга; они располагаются по спирали (рис.). Миозиновые нити стыкуются «хвост к хвосту».
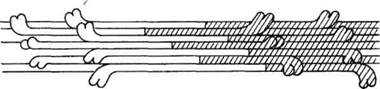
Рисунок. Упаковка миозиновых молекул при образовании толстого филамента
Миозин выполняет три биологически важные функции:
• При физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно.
• Миозин обладает каталитической активностью, т. е. является ферментом. В 1939 г. ВА Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения.
• Миозин связывает полимеризованную форму актина — основного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении.
Дата добавления: 2015-10-19; просмотров: 5295;
