Постоянная Авогадро и постоянная Лошмидта.
Количество вещества было бы лучше измерять числом молекул или атомов в теле, но так как N (количество молекул) очень велико, то в расчетах используют не абсолютное число молекул, а относительное.
В международной СИ количество вещества измеряют в молях.
Один моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
 Количество молекул в 1 моле вещества называется постоянной Авогадро и обозначается NА
Количество молекул в 1 моле вещества называется постоянной Авогадро и обозначается NА
NА 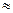 6 · 1023 моль-1
6 · 1023 моль-1
Количество молекул газа в единице объема при нормальных условиях р = 760 мм рт ст., 0˚ С,( 1 мм рт ст. = 133 Па) называется постоянной Лошмидта (или числом Лошмидта).
 Обозначается Пл
Обозначается Пл
Пл 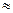 2,7· 1025
2,7· 1025 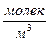
Количество вещества ν – равно отношению количества молекул N в данном теле к постоянной Авогадро, то есть к количеству молекул в одном моле:

ν = 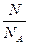 N – количество молекул
N – количество молекул
NА – постоянная Авогадро
 Молярной массой М вещества называют массу вещества, взятого в количестве 1 моля.
Молярной массой М вещества называют массу вещества, взятого в количестве 1 моля.
М = m0 NА
 m = m0N m - масса какого-либо количества вещества
m = m0N m - масса какого-либо количества вещества
m0 – масса одной молекулы; N – количество молекул в теле
 ν =
ν = 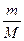 → количество вещества равно отношению массы вещества к его молярной массе.
→ количество вещества равно отношению массы вещества к его молярной массе. 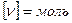 ,
, 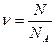 - отношение количества молекул в данном теле к количеству атомов в 12г Карбона.
- отношение количества молекул в данном теле к количеству атомов в 12г Карбона.
Количество молекул для какого-либо количества вещества может быть рассчитано по формуле:

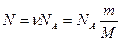
Связь между относительной молекулярной массой и молярной массой:
M = 10-3· Mr 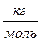 , где M – молярная масса, Mr – относительная молекулярная масса.
, где M – молярная масса, Mr – относительная молекулярная масса.
Концентрация – количество молекул в единице объему.
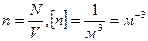
Плотность вещества:ρ= 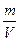 , [ ρ]=
, [ ρ]= 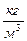
Опыт Штерна. Решающими для доказательства МКТ являются опыты, в которых непосредственно выявляются отдельные атомы или молекулы, а также измеряются скорости их движения. Первым кто измерил скорость движения отдельных молекул Аргентума был О. Штерн, в 1920 году, причем полученные опытным путем данные близки к теоретически обоснованным расчетам.
В опыте Штерна скорость молекул определялась при разных температурах, за счет изменения накаливания волоска, из которого происходило излучение вещества. Оказалось, что при повышении температуры скорость молекул увеличилась, а в случае снижения – уменьшилась. Это экспериментально подтверждает молекулярно-кинетическое определение абсолютной температуры.
Вопросы для самоконтроля:
1. Основные положения МКТ. Доказательство положений.
2. Броуновское движение.
3. Диффузия.
4. Силы молекулярного взаимодействия и их природа. Агрегатные состояния вещества.
5. Как посчитать относительную молекулярную массу?
6. Что такое один моль?
7. Чему равна постоянная Авогадро?
Литература
1. Дмитрієва В.Ф. Фізика: Навч. посіб..- К.: Техніка, 2008.-648 с.: іл..( §35-§40)
2. Владкова Р.А., Добронравов В.Є., Збірник задач і питань з фізики: Навч. посіб.- М.: Наука, 1988.-384 с.
Дата добавления: 2015-10-19; просмотров: 2011;
