Закон Авогадро
При одинаковых температурах и давлениях в равных объёмах различных идеальных газов содержится одинаковое количество молекул.
Масса газа в килограммах, численно равная молекулярной массе, называется: килограмм-молекула или киломоль (кмоль). Из закона Авогадро следует, что произведение 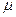 v (т.е. объём одного киломоля, где
v (т.е. объём одного киломоля, где 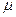 кг/кмоль – молекулярная масса однородного газа, а для смеси кажущаяся молекулярная или средняя молекулярная масса) есть величина одинаковая для всех газов и газовых смесей при одинаковых p и T . При нормальных физических условиях
кг/кмоль – молекулярная масса однородного газа, а для смеси кажущаяся молекулярная или средняя молекулярная масса) есть величина одинаковая для всех газов и газовых смесей при одинаковых p и T . При нормальных физических условиях
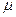 v = 22, 4 м
v = 22, 4 м 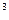 / кмоль. (3.6)
/ кмоль. (3.6)
Уравнение состояния для 1 кмоль газа называется уравнением Клапейрона - Менделеева и имеет вид
pV 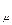 =
= 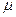 RT, (3.7)
RT, (3.7)
где
V 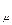 =
= 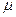 v,
v,
при этом
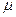 R = R
R = R 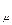 = 8,314 кДж /(кмоль
= 8,314 кДж /(кмоль 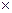 град.
град.
Величина R 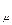 является универсальной газовой постоянной, одинаковой для киломоля любого однородного газа или газовой смеси. Универсальная газовая постоянная для 1 кг газа ( R ) определяется из соотношения
является универсальной газовой постоянной, одинаковой для киломоля любого однородного газа или газовой смеси. Универсальная газовая постоянная для 1 кг газа ( R ) определяется из соотношения
R = 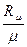 . (3.8)
. (3.8)
Вопросы для самоконтроля
1. Что называется уравнением состояния?
2. Для чего вводится в техническую термодинамику понятие об идеальном газе?
3. Законы Бойля – Мариотта и Гей-Люссака. Их определения и уравнения.
4. Что называется молекулярной массой газа?
5. Характеристическое уравнение состояния для идеального газа.
6. На каких законах основан вывод уравнения состояния Клапейрона?
7. Уравнение Клапейрона для любого количества газа.
8. Размерность всех величин, входящих в уравнение Клапейрона.
9. Размерность газовой постоянной и ее физический смысл.
10. Что называется киломолем газа?
11. Закон Авогадро, определение и выводы из этого закона.
12. На каких законах основан вывод уравнения Д. И. Менделеева?
13. Дать определение универсальной газовой постоянной и ее размерность.
Дата добавления: 2015-09-02; просмотров: 984;
