Пептидная
связь
Следует подчеркнуть, что пептидные связи образуются только за счет взаимодействия амино- и карбоксильных групп, обязательно входящих в общую часть белковой молекулы. Амино- и карбоксильные группы, находящиеся в радикале некоторых аминокислот (см. табл. 1), участия в формировании пептидных связей не принимают.
Пептидные связи, являясь ковалентными, обладают высокой прочностью, их образуют все аминокислоты.
В состав полипептидов входят десятки, сотни и тысячи остатков аминокислот. У каждого полипептида аминокислотные остатки распола- гаются в строгой последовательности, закодированной в молекулах ДНК..
Таким образом, полипептиды отличаются друг от друга количеством аминокислотных остатков и последовательностью их расположения в полипептидных цепях.
В состав белковой молекулы входит один или несколько полипептидов.


 Кроме пептидных, в белках обнаруживаются еще дисульфидные связи, которые также являются ковалентными. В образовании таких связей участвуют только аминокислота цистеин. В радикале цистеина содержится SH-группа, за счет которой остатки цистеина могут соединяться друг с другом:
Кроме пептидных, в белках обнаруживаются еще дисульфидные связи, которые также являются ковалентными. В образовании таких связей участвуют только аминокислота цистеин. В радикале цистеина содержится SH-группа, за счет которой остатки цистеина могут соединяться друг с другом:



 CH2-SH HS-CH2 CH2 - S –S -CH2
CH2-SH HS-CH2 CH2 - S –S -CH2


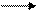

 H-C-NH2 + H-C-NH2 - 2Н H-C-NH2 H-C-NH2
H-C-NH2 + H-C-NH2 - 2Н H-C-NH2 H-C-NH2


 COOH COOH COOH COOH
COOH COOH COOH COOH
Дисульфидной связью являются два атома серы, с помощью которых происходит соединение двух остатков молекул цистеина. Эту связь еще называют дисульфидным мостиком. (Два остатка цистеина, соединенных дисульфидной связью, имеют название цистин. Однако цистин не кодируется и не участвует в синтезе белковой молекулы. Поэтому цистин не является протеиногенной аминокислотой).
В молекулах белков дисульфидная связь возникает между остатками цистеина, входящими в состав полипептидов.
В одних случаях остатки цистеина находятся в разных участках одного и того же полипептида и обязательно пространственно сближены. Благодаря образованию дисульфидной связи, полипептидная цепь приобретает определенную пространственную форму.
Дисульфидной связью могут также соединиться остатки цистеина, находящиеся в разных полипептидах, но пространственно сближенные. Образование дисульфидной связи в этом случае приводит к объединению полипептидов в общую молекулу.
По сравнению с пептидной связью дисульфидная связь является менее прочной. Количество дисульфидных связей в молекулах белков намного меньше, чем пептидных.
Наряду с ковалентными связями в молекулах белков могут встречаться и слабые нековалентные связи, к которым относятся водородные, ионные и другие связи. Эти химические связи могут возникать между остатками аминокислот, расположенных в разных участках одного и того же полипептида, и пространственно сближенных. Образование таких связей также способствует формированию пространственной формы белковой молекулы.
Дата добавления: 2015-10-19; просмотров: 1271;
