Виды оперативного лечения.
Хирургическое вмешательство по поводу острой кишечной непроходимости - одна из наиболее сложных операций в неотложной абдоминальной хирургии. Технические трудности еще более возрастают, если операцию выполняют повторно, после уже перенесенных больным ранее вмешательств (нередко многократных).
Наиболее типичным доступом при лечении острой кишечной непроходимости является средне-срединная лапаротомия. При необходимости разрез может быть расширен кверху или книзу. При наличии на брюшной стенке рубцов после ранее перенесенных операций вскрытие брюшной полости лучше осуществить выше или ниже края рубца, чтобы избежать повреждения припаявшейся к рубцу петли кишки. После вскрытия брюшины из брюшной полости удаляют патологическое содержимое (транссудат, экссудат, кишечное содержимое), если оно имеется. Затем осторожным поэтапным рассечением спаек освобождают края брюшной стенки на всем протяжении ее разреза, брюшную полость отграничивают стерильным бельем и начинают следующий этап операции - ревизию брюшной полости с целью установления природы непроходимости.
Общим принципом этого этапа являются его последовательность и щадящий характер. Ревизии кишечных петель необходимо предпослать блокаду корня брыжейки тонкой и поперечной ободочной кишки. Для определения уровня непроходимости используют визуальную оценку поперечного размера различных сегментов кишечника. Выше уровня препятствия кишечные петли всегда переполнены содержимым, а ниже препятствия находятся в спавшемся состоянии. Ориентировка по этому признаку может быть затруднена, если операцию выполняют в поздние сроки в условиях разлитого перитонита, когда присоединяется выраженный парез, а изменения париетальной брюшины распространяются на все отделы кишечника.
После установления причины и уровня непроходимости оперативное пособие сводится к решению ряда последовательных задач:
1) устранению непроходимости кишечника;
2) оценке жизнеспособности кишки в зоне препятствия;
3) определению показаний к резекции кишки и дренированию кишечной трубки;
4) ликвидации (по возможности) основного заболевания, вызвавшего острую кишечную непроходимость, и устранению причин рецидива непроходимости;
5) санации и дренированию брюшной полости при наличии перитонита.
Важным принципом устранения кишечной непроходимости следует считать выбор щадящего, но достаточно радикального способа, надежно устраняющего механическое препятствие кишечному пассажу. Объем этого этапа вмешательства может быть различным - от обширной резекции кишки до наложения разгрузочного кишечного свища или обходного межкишечного соустья. Выбор способа устранения непроходимостиобычно зависитот ее вида и тяжести поражения кишечной стенки.
При обтурации, вызванной опухолью тонкой кишки, производят одномоментную резекцию.
При закупорке кишечника желчным камнем, фитобезоаром, инородным телом следует продвинуть последние ниже,сделать энтеротомию на неизмененном участке кишки, удалитьих и застойное содержимое кишечника и ушить кишечник двухрядным швом. В случае нежизнеспособности кишечника показана резекция измененного участка кишки.
При непроходимости, вызванной аскаридами, следует попытаться переместить их из тонкого кишечника в толстый. В тяжелых случаях показана энтеротомия с извлечением аскарид.
Заворот тонкого кишечника подлежит срочному оперативному вмешательству, которое заключается в расправлении завернувшихся петель, рассечении спаек. Места перехода спаек и десерозированные участки кишки должны быть тщательно ушиты. Завернувшуюся петлю после устранения странгуляции согревают салфетками, смоченными в теплом растворе хлорида натрия, после чего определяют жизнеспособность кишечной стенки. Признаки ее нежизнеспособности: темный цвет, отсутствие перистальтики и пульсации сосудов на кишке и брыжейке. Если кишка жизнеспособна, производят туалет брюшной полости, в брыжейку кишки вводят 0,25% раствор новокаина, ушивают десерозированные участки и брюшную полость зашивают наглухо.
При малейшем подозрении на неполноценность завернувшейся кишки показана резекция ее в пределах здоровых тканей. Следует помнить, что некроз обычно развивается со стороны слизистой, часто в виде небольших очагов, поэтому удалять кишечник следует, отступя от измененного участка 30-40 см в проксимальном и 15-20 см в дистальном направлении (Рис.1). Анастомозы, как правило, накладывают конец в конец.
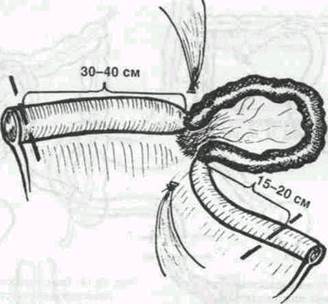
Рис.1. Объем резекции кишки при странгуляционной кишечной непроходимости
При завороте илеоцекального отдела кишечника и жизнеспособности кишечной стенки после устранения заворота показана операция - укорочение брыжейки слепой кишки или цекопексия, при которой слепую кишку помешают под париетальный листок брюшины. При гангрене слепой кишки производят ее резекцию. Лучше резекцию выполнять в средней трети восходящего участка толстой кишки или в области правого угла и накладывать анастомоз бок в бок.
При узлообразовании петель тонкого кишечника в случае его жизнеспособности следует произвести раскручивание узла. Для облегчения развязывания узла иногда прибегают к опорожнению от содержимого петель, вовлеченных в узел, путем пункции. При узлообразовании с участием сигмовидной кишки опорожнять последнюю лучше через резиновую трубку, введенную в прямую кишку. Если развязать узел не удается или кишка нежизнеспособна, следует сразу сделать резекцию кишечных петель, участвующих в образовании узла. При резекции тонкой кишки целостность ее восстанавливается анастомозом. Резекцию толстой кишки заканчивают наложением одно- или двуствольного подвздошного ануса.
Оперативное лечение инвагинации заключается в дезинвагинации, которая в некоторых случаях осуществляется легко, а в других из-за отека кишки представляет определенные трудности. Дезинвагинацию производят посредством выдавливания внедренного со стороны головки инвагината. Затем определяют жизнеспособность кишки. При дезинвагинации путем вытягивания может возникнуть разрыв кишки. При выраженном сращении и некрозе показана резекция измененного участка кишечника.
Здесь же хотелось бы подчеркнуть необходимость творческого подхода в выборе способа устранения морфологического субстрата спаечной тонкокишечной непроходимости в ходе оперативного вмешательства. Иногда для устранения непроходимости достаточно просто пересечения одного - двух спаечных тяжей, сдавливающих просвет кишки. При значительном распространении в брюшной полости спаечного процесса, когда трудно определить зону основного механического препятствия, рассечение спаек превращается в длительную сложную манипуляцию, в ходе которой нередко повреждается серозный покров отдельных кишечных петель. Все такие повреждения должны быть замечены и ушиты в поперечном направлении. После освобождения из спаек тонкой кишки на всем ее протяжении в предвидении нового спаечного процесса целесообразно провести интубацию кишки одним из обсуждавшихся ранее способов с тщательным последовательным укладыванием кишечных петель на трубке как на каркасе. В итоге кишечные петли фиксируются вновь формирующимися спайками в функционально выгодном положении, препятствующем развитию острой кишечной непроходимости.
Если же спаечный процесс имеет локальный характер и захватывает менее 1/3 общей длины тонкой кишки, то, учитывая опасность повреждения серозного покрова и возможность последующего формирования новых спаек, разъединение конгломерата далеко, не всегда рационально. В этих случаях могут оказаться более целесообразными резекция всего конгломерата или наложение обходного анастомоза.
Для предохранения петель от обширных и хаотических сращений предложена (Нобль, 1933) энтеропликация: кишечные петли, освобожденные от спаек, укладывают в виде вертикально направленных параллельных рядов длиной 25-30 см и сшивают серо-серозным швом, который переходит на брыжейку, протяженность его до 6 см. Весь кишечник таким образом укладывают от слепой кишки до трейцевой связки.
В дальнейшем операция Нобля неоднократно подвергалась различным модификациям. К.С. Симонян (1966) предложил укладывать петли кишечника в горизонтальном направлении, как более физиологичном, накладывать серозно-мышечные швы без перехода на брыжейку, для улучшения сращения делать на серозе кишки продольные насечки. Чайлдс (1960) предложил фиксировать петли кишечника только ушиванием брыжейки. Перистальтика кишечных петель при этом остается свободной, послеоперационный период протекает легче. Д.П. Чухриенко (1972) разработал трансмезентериальную интенстинопликацию тремя П-образными швами с упорными полосками из лавсана. Швы накладываются через бессосудистые участки брыжейки. Ю.Ф. Исаков, Г.Г. Шмидт (1970) предложили фиксацию кишечных петель с помощью цианокрилатного клея, что, по их мнению, уменьшает травматичность и продолжительность оперативного вмешательства. Операцию Нобля и ее модификации при обширных и рецидивирующих спаечных процессах применяют в холодном периоде.
Резекция тонкой кишки как компонент оперативного вмешательства при острой кишечной непроходимости заслуживает особого рассмотрения. Многие вопросы, связанные с этим этапом, остаются сложными и не получили еще своего окончательного разрешения. Прежде всего, это относится к трудностям определения жизнеспособности кишки и объема ее резекции. На эти трудности указывали многие хирурги. С неправильной оценкой жизнеспособности кишки и неадекватным вследствие этого определением объема резекции связаны многие послеоперационные осложнения при острой кишечной непроходимости и прежде всего несостоятельность швов анастомозов.
Наиболее распространенные критерии определения жизнеспособности кишки - пульсация сосудов брыжейки, наличие перистальтики кишки, цвет серозного покрова - нельзя считать достоверными даже при наблюдении в течение нескольких минут в условиях согревания сомнительной кишки салфетками, смоченными теплым стерильным раствором. В литературе представлены многочисленные наблюдения, когда внешние признаки относительного благополучия сочетались с обширным некрозом слизистой оболочки.
В связи с этим в неотложной абдоминальной хирургии существует правило, диктующее необходимость выполнения резекции кишки не только в случае ее явной нежизнеспособности, но и при обоснованных сомнениях в ее жизнеспособности (А. Е. Норенберг-Чарквиани, 1956; В. И. Стручков, 1981).
Это правило применимо, когда речь идет о резекции относительно небольшого участка кишки без тяжелого разлитого перитонита у больного с сохраненными компенсаторными резервами.
Если же вопрос стоит об обширной или субтотальной резекции тонкой кишки, да еще у пожилого ослабленного больного, то при отсутствии безусловных признаков необратимых изменений в кишечной стенке риск выполнения такого пособия нередко конкурирует с риском выжидательной тактики. В подобной ситуации в некоторых, особенно зарубежных работах, рекомендуется тактика запланированной релапаротомии через 10-12 ч («Second look operation»), во время которой изменения в кишке оценивают с большей достоверностью. В.М. Буянов и соавт. (1984) с этой целью используют лапароскопию через специально оставляемую в брюшной стенке металлическую гильзу. Я.В. Гоер с соавт. (1991) при сомнении в жизнеспособности участка кишки, а также при выраженных изменениях брюшины оперативное вмешательство завершали созданием лапаростомы с программированной релапаротомией через 24-72 ч после первой операции.
Не менее сложным, чем установление показаний к резекции кишки, является вопрос об определении границ резекции. Даже небольшие изменения в состоянии микроваскулярного ложа кишечной стенки могут решающим образом неблагоприятно сказаться на заживлении межкишечного соустья. В настоящее время для профилактики несостоятельности шва анастомоза при некрозе кишки большинство авторов рекомендуют производить резекцию, отступя 30-40 см в проксимальном направлении и 15-20 см в дистальном (В. В. Румянцева, 1958; В. Г. Астапенко, С. С. Максимов, 1982; В. С. Савельев, 1986). Исследования В.Н.Чернов и Б.М. Белика (1991) свидетельствуют, что резекцию приводящего отдела следует производить на расстоянии не менее 60 см выше препятствия, отводящего не менее 40 см, так как нарушение внутристеночной гемоциркуляции рефлекторного характера распространяется на 40-50 см выше и 20-30 см ниже препятствия. При небольших по объему резекциях в среднем отделе тонкой кишки выполнение этого правила в большинстве случаев не вызывает затруднений. Однако, когда речь идет об обширных и субтотальных резекциях тонкой кишки или когда резекцию необходимо производить в непосредственной близости от илеоцекального угла, могут возникнуть значительные трудности. Тогда методы объективной оценки состояния внутристеночного кровотока приобретают особое значение. Одним из таких методов, доступность и практическая рациональность которого получала подтверждение в последние годы, является метод трансиллюминационной тензометрии, предложенный в 1971 г. 3. М. Сигалом и его модификации.
Для оценки внутристеночных микроциркуляторных расстройств и жизнеспособности кишки В.Н. Чернов и Б.М. Белик (1991) предложили использовать метод интраоперационной биомикроскопии. Для количественной оценки нарушений внутристеночной микроциркуляции предложена балльная система.
В настоящее время большое количество хирургов для интраоперационного восстановления регионарной гемодинамики кишки применяют согревание ее салфетками с горячим физиологическим раствором и введение в брыжейку 50-60 мл 0,25% раствора новокаина (Р.А. Женчевский, 1989; В.П. Петров, 1989). С целью восстановления жизнеспособности в брыжейку вводят гепарин-фибринолизин-новокаиновую смесь (15000 ЕД гепарина, 15000 ЕД фибринолизина, 5 мл 2% раствора новокаина, 300 мл 0,9% раствора хлорида натрия) (А.И. Лысенко, 1984).
Выполнение оперативного пособия у больных с острой кишечной непроходимостью в поздние сроки, в условиях развившегося перитонита имеет свои особенности. Они связаны, прежде всего, с необходимостью тщательной санации брюшной полости во время операции. Неполноценность этого этапа не может быть восполнена никакими усилиями в послеоперационном периоде. Санация состоит в дополнительной ревизии после устранения морфологического субстрата непроходимости всех отделов брюшной полости и тщательного их осушивания. Затем осуществляют многократное промывание брюшной полости теплыми растворами (изотонический раствор хлорида натрия, фурацилин). Промывание выполняют щадящим способом, без эвентрации кишечных петель. Подогретый до 37-40 °С раствор заливают в брюшную полость в таком количестве, чтобы петли кишок плавали в нем. После промывания раствор удаляют с помощью электроотсоса. Промывание производят до «чистой воды», для чего требуется обычно 8-12 л раствора. После окончания промывания в брюшную полость заливают 500 мл 0,25 % раствора новокаина с антибиотиками. Наличие разлитого гнойного перитонита является дополнительным основанием для дренирования тонкой кишки у больных с острой кишечной непроходимостью.
Операцию при разлитом перитоните завершают созданием условий для полноценной санации брюшной полости в послеоперационном периоде. С этой целью у больных можно наложить систему для проточного или фракционного орошения брюшной полости. В последнем случае через проколы в правом и левом подреберьях в поперечном направлении проводят дренажную трубку диаметром 3-4 мм с множественными перфорационными отверстиями на протяжении той ее части, которая находится в брюшной полости. Оба выведенных конца трубки служат для капельного или фракционного введения растворов антибиотиков. Для активной аспирации скопившейся жидкости в полость малого таза через разрез в подвздошной области вводят дренажную двухпросветную трубку. Завершают операцию при разлитом перитоните послойным ушиванием раны брюшной стенки.
При выраженном интоксикационном синдроме в качестве дополнительного хирургического пособия может быть рекомендовано дренирование грудного протока для последующей лимфосорбции с целью детоксикации.
В последние годы в программе комплексного лечения кишечной непроходимости наметился ряд новых подходов. Важнейшей мерой борьбы с эндогенной интоксикацией и параличом кишечника, профилактики недостаточности межкишечных анастомозов и развития спаечной болезни стала интубационная декомпрессия кишечника, появились данные об использовании одномоментной декомпрессионной интубации тонкой кишки. Подавляющее большинство авторов во время операций по поводу острой спаечной кишечной непроходимости используют интубацию кишок, считая ее, обязательным этапом хирургического лечения. Применение интубации значительно снижает процент послеоперационных осложнений и улучшает отдаленные результаты.
В настоящее время для кишечной декомпрессии приняты следующие методы: постоянная желудочная аспирация (назогастральный зонд), кишечная интубация через носоглотку с помощью специальных зондов, кишечная интубация через гастростому, кишечная интубация через илеостому или слепую кишку.
Достоинства перечисленных методов декомпрессии желудочно-кишечного тракта достаточно полно освещены в литературе и не вызывают возражений, если не считать некоторых их недостатков: постоянная желудочная аспирация является обязательным компонентом любого метода дренирования, однако она не может обеспечить освобождения от газов и жидкостей кишечник, поскольку опорожнение последнего в желудок наступает по типу регургитации только при крайних степенях пареза, да и то частично.
При назоинтестинальной интубации существуют трудности при проведении зонда, обусловленные анатомическими особенностями. Кроме того, длительное нахождение зонда может привести к носовым кровотечениям, ларингитам, фарингитам пневмонии, пролежням кишки, инвагинации кишки при извлечении зонда, завязыванию зонда узлом. Травма кишки при проведении зонда приведет к выделению в ее просвет белков, электролитов и жидкости, что усугубляет нарушения белкового и водно-электролитного обмена. При изучении в эксперименте влияния внутрипросветного дренажа на заживление анастомозов было установлено, что дренаж замедляет заживление, вызывая раздражение кишок в зоне анастомоза. Следует иметь в виду, что при обтурации его просвета он сам может явиться причиной внутрипросветной гипертензии.
Кишечная интубация через гастростому хотя несколько облегчает, но полностью не снимает сложности проведения зонда за двенадцатиперстную кишку, требует изготовления специальных зондов. Как и при назогастральной интубации, дренажная трубка устанавливается в каудальном направлении, и опорожнение кишки должно происходить по типу антиперистальтических движений.
Дренирование тонкой кишки через энтеростому, например, метод И.Д. Житнюка (1975), который широко применялся в неотложной хирургии до появления промышленно выпускаемых зондов для назогастральной интубации. Он предполагает ретроградное дренирование тонкой кишки через подвесную илеостому. Существует метод антеградного дренирования через еюностому по J.W. Baker (1959), раздельное дренирование проксимальных и дистальных отделов тонкой кишки через подвесную энтеростому по White (1949) и их многочисленные модификации. Данные методы представляются наименее предпочтительным в силу возможных осложнений со стороны энтеростомы, опасности формирования тонкокишечного свища на месте энтеростомы и т.д. Ретроградное дренирование тонкой кишки через микроцекостому может быть использовано при невозможности антеградной интубации. Недостатками метода являются сложность проведения зонда через баугиниеву заслонку и нарушение функции илеоцекального клапана. Цекостома после удаления зонда, как правило, заживает самостоятельно. Вариантом предыдущего способа является метод дренирования тонкой кишки через аппендикостому.
Наиболее частые осложнения при наложении стомы - это образование параcтомических абсцессов, отхождение стомы в брюшную полость, мацерации кожи вокруг стомы. Количество осложнений достигает 35%. В то же время, при отсутствии перистальтики наложение стомы не обеспечивает декомпрессии, а опорожняет только близлежащие отделы кишечника, а декомпрессия возможна только при интубации кишечника через стому.
Особого внимания заслуживает вопрос о целесообразности наложения "высокой илеостомы". По мнению Г.Б. Исаева (2000) наложение "высокой илеостомы" чревато опасностью резкого нарушения обмена веществ и развития кахексии в кратчайшие сроки; этим больным на фоне перитонита после резекции тонкой кишки целесообразно наложение еюноеюноанастомоза и проведение назогастроеюнального зонда за анастомоз. Постоянная эвакуация содержимого через двухпросветный зонд позволяет создать адекватную декомпрессию и способствует заживлению анастомоза. Напротив, Г.И. Калиашвили (1984) рекомендует высокие стомы, как физиологичный и поэтому наиболее эффективный метод декомпрессии желудочно-кишечного тракта.
При анализе методов дренирования желудочно-кишечного тракта необходимо подчеркнуть принципиальное положение. Все авторы, применявшие интубацию «сверху» или «низу», приходят к выводу, что эффект достигается только тогда, когда конец зонда находится в начальной части тонкой кишки. В связи с этим Ю.М. Дедерер (1971) отказался от проведения зонда на значительное расстояние по тонкой кишке и проводит зонд только на 20-30 см ниже связки Трейтца, а Ю.А. Гегечкори и Р.С. Поповьянц (1998) интубируют тонкую кишку через илеостому обязательно на всем ее протяжении, т.е. до связки Трейтца. Следовательно, эффективное дренирование кишечника возможно при достаточном опорожнении от жидкости и газов именно верхних его отделов. Весьма существенно, что при этом должны быть созданы условия для поддержания постоянного оптимального давления в дуоденальной зоны, т. е. на участке, несущем водитель ритма всего кишечника, чтобы дренирующая система работала по принципу предохранительного клапана, позволяющего в любой момент устранить перерастяжение кишечника стенки именно в этом отделе.
Ряд авторов у больных, оперированные по поводу спаечной болезни, рекомендуют интубировать всю тонкую кишку, несмотря на то что, по мнению этих авторов достаточной является интубация начальных 80 - 100 см тощей кишки. А.Г. Бебуришвили с соавторами (2003) считают, что конец зонда должен находиться в куполе слепой кишки независимо от степени спаечного процесса и выраженности изменений в тонкой кишке. Этот технический прием выполняется в связи с тем, что после укладки зонда происходит "соскальзывание" дистальных петель подвздошной кишки. Нахождение зонда в слепой кишке, несмотря на нефизиологичность (травма баугиниевой заслонки, рефлюкс кишечного содержимого), длится сравнительно недолго - до восстановления перистальтики. Меньший объем шинирования тонкой кишки чреват развитием ранней спаечной кишечной непроходимости.
Б.К. Шуркалин (1999) рекомендует назоинтестинальную интубацию заканчивать при достижении оливой зонда илеоцекального угла. Заводить зонд в слепую кишку не следует во избежание заброса толстокишечного содержимого в тонкую кишку, что приводит к контаминации толстокишечной микрофлорой. С.А. Алиев (1996) считает необходимым проводить тотальную декомпрессию путем трансназальной и трансанальной интубации кишечника. В 18% наблюдений выполнена дивульсия сфинктера прямой кишки по Рекамье.
Большинство хирургов рекомендуют проводить интубацию кишечника только при резком перерастяжении стенки кишки и наличии в ней морфофункциональных и гемоциркуляторных нарушений. Другие же считают показанием к интубации выраженный распространенный спаечный процесс в брюшной полости, когда для надежного устранения непроходимости требуется рассечение множества спаек.
Показания к наложению стом так же активно обсуждаются в литературе. Большинство авторов ограничивают показания к выведению стом наличием пожилого и старческого возраста больных с тяжелыми сопутствующими заболеваниями сердечно-сосудистой и дыхательной систем, наличием заболеваний, обеспечивающих высокий риск послеоперационных осложнений в результате длительного нахождения зонда в просвете кишки (сахарный диабет и т.д.), технической невозможность интубации кишечника (заболевание носоглотки и пищевода, спаечный процесс верхних отделов брюшной полости). Так же встречаются мнения о необходимости наложения стом при вынужденной резекции тонкой кишки, на фоне гнойного перитонита, из-за нежизнеспособности ее стенки и при необходимости декомпрессии кишечника при разлитом перитоните.
В последнее время в литературе стали появляться сообщения о трансанальной интубации тонкого кишечника при острой тонкокишечной непроходимости. Известно, что эффективность декомпрессии определяется скоростью оттока застойного кишечного содержимого по интубационной трубке, обратно пропорциональной длине трубки и прямо пропорциональной радиусу трубки в четвертой степени. Однако при трансназальном способе введения диаметр трубки не может быть более 4 - 6 мм. Исходя из необходимости использования трубки большого диаметра (10 - 12 мм), позволяющей увеличить скорость декомпрессии в 16 раз, а также учитывая нежелательность трансназального введения трубки у ослабленных больных с заболеваниями органов дыхания, носоглотки и пищевода, С.Г. Григорьев и соавторами (1990) выполняют трансанальную тотальную интубацию кишечника. Зонд проводится через всю тонкую кишку до дуоденоеюнального перехода. К положительным качествам его следует отнести отсутствие необходимости в определении сроков экстубации: зонд выделяется самостоятельно по мере восстановления перистальтики. К отрицательным сторонам следует отнести технические сложности интубации и неизбежную контаминацию содержимого толстого кишечника в тонкую кишку.
Другим нерешенным и дискутируемым вопросом является определение сроков экстубации. Длительность назоинтестинального дренирования, выполняемого с целью каркасного шинирования тонкой кишки при массивном адгезнолизисе и опасности возникновения ранней СКН, определяется сроками адгезии соприкасающихся в определенном порядке петель и составляет 5-6 сут. Продолжительность назоинтестинального зондирования у пациентов, оперированных на поздней стадии ОСКН, зависит от сроков восстановления перистальтики, появления самостоятельного стула, уменьшения интоксикации и составляет 5-7 сут. Более длительное нахождение зонда в просвете кишечника не имеет смысла, так как отсутствие признаков восстановления пассажа по ЖКТ, сохраняющаяся эндогенная интоксикация свидетельствуют о наличии осложнений, требующих повторной операции.
Применение назогастрального зондирования позволяет с первых суток использовать лаваж и энтеросорбцию у больных с признаками эндогенной интоксикации. Назоинтестинальный лаваж заключается в промывании ЖКТ изотоническим раствором хлорида натрия или обычной водой порциями от 0,5 до 1,0 л 2-7 раз в сутки. В качестве энтеросорбентов можно использовать полифепан, энтеродез, энтеросорб, угольные сорбенты с одновременным включением в схему лечения препаратов, воздействующих на анаэробную микрофлору: гипохлорит натрия, перманганат калия, перекись водорода. Продолжительность лаважа составляет в среднем 3 суток.
Дата добавления: 2015-10-13; просмотров: 1966;
