Методы контроля качества основных (базисных) гомеопатических препаратов
Контроль качества основных гомеопатических препаратов можно подразделить на 2 этапа:
а) контроль физико-химических свойств и технологических параметров;
б) аналитический контроль по действующим веществам.
Жидкие базисные препараты (эссенции, настойки, растворы) контролируют в соответствии с требованиями руководства В. Швабе «Гомеопатические лекарственные средства» и ГФ по следующим показателям:
Ø соответствие запаха и вкуса;
Ø прозрачность (отсутствие механических включений);
Ø соответствие окраски, т. к. ряд препаратов, особенно приготовленных из свежих растений при длительном хранении изменяют свою окраску (например, часто наблюдается изменение зеленой окраски в коричневую, вызванное в большинстве случаев изменением хлорофилла). Кроме того, может также изменяться интенсивность окраски в различных пробах одного и того же препарата, несмотря на равное содержание лекарственного вещества, что особенно заметно в самых высоких разведениях. Этот факт необходимо учитывать при оценке приведенных сведений об окраске различных веществ.
Окраску определяют визуально при дневном отраженном свете на матово-белом фоне (белый картон или писчая бумага) в пробирках одинакового стекла диаметром 10 мм.
Ø капиллярный и капиллярно-люминесцентный анализ:
а) капиллярный анализ эссенций, настоек и жидких разведений проводят по методу «Плана»: из фильтровальной или хроматографической бумаги одного сорта в направлении, перпендикулярном текстуре бумаги, нарезают полоски шириной 2 см и длиной приблизительно 25 см и подвешивают в цилиндрическом стеклянном сосуде, высотой около 5 см и диаметром около 3 см так, чтобы концы бумажных полосок касались дна сосудов. В сосуд, если не оговорены другие условия проведения анализа, помещают обычно 5 мл исследуемого раствора. Сосуд ставят в умеренно теплое помещение и через 24 часа или к моменту, когда вся жидкость будет поглощена вынимают полоски, просушивают и исследуют при дневном свете или же в ультрафиолетовом свете, излучаемом кварцевой аналитической лампой. При исследовании более высоких разведений вместо широких капиллярных полосок используются полоски шириной не более 2,5 мм.
При описании капиллярной картины пользуются делением на 2 части:
Верхняя часть, состоящая из водной зоны и часто зоны в виде выпуклости или эллиптической выемки.
Нижняя часть, большей частью состоящая из нескольких зон, окрашенных в разные цвета, и основания.
Контролем служат данные капиллярного анализа эссенций или настоек, приведенные для каждого объекта в руководстве В.Швабе;
б) капиллярно-люминесцентный анализ, разработанный Нейгебауэром и Платцем, принятый в международной гомеопатической фармакопее, уточнен и приспособлен для условий аптеки или лаборатории как метод, дающий ясную картину специфичности средства и правильности приготовления лекарств.
При наблюдении люминесценции жидкости исследуемой методом капиллярного анализа целесообразнее всего также оказалось разделение на 2 части:
Верхнюю часть, которая состоит из узкой самой верхней зоны, затем собственно верхней части и основания верхней части, ясно наблюдаемого при люминесценции целого ряда препаратов.
Нижнюю часть, которая состоит из выпуклой части или свода, полосы, состоящей из нескольких зон и основания; полоса может занимать всю нижнюю часть или только выпуклую зону.
Данные капиллярного анализа наблюдают при свете аналитической УФ-лампы обычно после просушки, так как при этом наиболее полно проявляется характерная люминесценция. При наблюдении капиллярных картин в ультрафиолетовом свете для того, чтобы избежать ошибок, необходимо обращать внимание на следующее: как при дневном свете, так и при освещении лампой наблюдение нужно всегда проводить на одинаковом фоне, лучше всего белом, по возможности не люминесцентном. Кроме того, надо знать, что и от фильтровальной бумаги появляется, как правило, бледно-голубая или сине-фиолетовая люминесценция, а также, что различные вещества, как, например, молочный или тростниковый сахар, имеют часто собственную люминесценцию голубого цвета, которая может проявляться также при исследовании спиртового экстракта и затруднять определение вещества. Этиловый спирт также имеет слегка голубую люминесценцию. Нужно следить также за тем, чтобы у холостых проб с очищенной водой, на верхнем конце капиллярных картин всегда появлялась узкая зона, окрашенная в коричневатый цвет. В ультрафиолетовом излучении она светится ярко-синим светом. В целях более точного исследования препарат нужно обработать соответствующими реактивами, после чего можно наблюдать характерные изменения окраски при дневном, а особенно ультрафиолетовом свете. Рекомендуется обильно наносить раствор на все зоны стеклянной палочкой или капельной пипеткой и высушивание проводить при слегка повышенной температуре. В сомнительных случаях рекомендуется проводить холостую пробу на той же полоске бумаги, но выше капиллярной картины.
Если применение реактивов недостаточно для доказательства идентичности, то можно использовать описанный ниже метод (2-я капилляризация): исследуемую фильтровальную бумагу с капиллярной картиной помещают в пробирку, затем наливают (до верхней границы капиллярной картины) соответствующий растворитель, чаще всего хлороформ (чтобы помешать тому, чтобы верхняя часть картины случайно не была бы барьером для растворителя и веществ, растворяющихся в нем). Растворитель растворяет все содержащиеся в окрашенном участке фильтровальной бумаги растворимые вещества и вместе с ними поднимается по бумаге. Затем эти вещества испаряются и отлагаются в новой зоне, на верхнем краю пробирки.
Если эта «новая зона» получается слишком слабой, то опыт можно повторить с добавочной порцией растворителя, и следовательно повысить интенсивность этой зоны. Если эта зона слишком темна, то можно снова нанести растворитель, расширить этим зону и, таким образом, просветлить её.
Новая более или менее широкая зона имеет часто характерный цвет и при дневном свете и при ультрафиолетовом освещении. В случае необходимости ее исследование, как и капиллярной картины, можно продолжать разными методами. Растворы проверяют на люминесценцию непосредственно; для этого 1-2 мл помещают в пробирку диаметром около 1,5 см и наблюдают в ультрафиолетовом свете. К раствору добавляют несколько капель хлористоводородной кислоты, чтобы исключить, особенно при высоких разведениях, помехи, вызываемые влиянием имеющейся щелочи;
Ø определение плотности жидкостей проводят с помощью пикнометра или ареометра:
Метод 1. Применяют в случае определения плотности жидкостей с точностью до 0,001. Чистый сухой пикнометр взвешивают с точностью до 0,0002 г, заполняют с помощью маленькой воронки очищенной водой немного выше метки, закрывают пробкой и выдерживают в течение 20 мин в термостате, в котором поддерживают постоянную температуру воды 20°С с точностью до 0,1°С. При этой температуре уровень воды в пикнометре доводят до метки, быстро отбирая излишек воды при помощи пипетки или свернутой в трубку полоски фильтровальной бумаги. Пикнометр снова закрывают пробкой и выдерживают в термостате еще 10 мин, проверяя положение мениска по отношению к метке. Затем пикнометр вынимают из термостата, фильтровальной бумагой вытирают внутреннюю поверхность горлышка пикнометра, оставляют под стеклом аналитических весов в течение 10 мин и взвешивают с той же точностью.
Пикнометр освобождают от воды, высушивают, споласкивая последовательно спиртом и эфиром (сушить пикнометр путем нагревания не допускается), удаляют остатки эфира продуванием воздуха, заполняют пикнометр испытуемой жидкостью и затем производят те же операции, что и с очищенной водой.
Плотность r20 (г/см3) вычисляют по формуле:
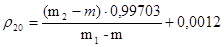 ,
,
где m – масса пустого пикнометра в граммах; m1 – пикнометра с очищенной водой в граммах; m2 – масса пикнометра с испытуемой жидкостью в граммах; 0,99703 – значение плотности воды при 20°С (в г/см3 с учетом плотности жидкостей с учетом плотности воздуха); 0,0012 – плотность воздуха при 20°С и барометрическом давлении 1011 гПа (760 мм рт.ст.).
Метод 2. Применяют в случае определения плотности жидкостей с точностью до 0,01. Испытуемую жидкость помещают в цилиндр при температуре жидкости 20°С осторожно опускают в нее чистый сухой ареометр, на шкале которого предусмотрена ожидаемая величина плотности. Ареометр не выпускают из рук до тех пор, пока не станет очевидным, что он плавает; при этом необходимо следить, чтобы ареометр не касался стенок и дна цилиндра. Отсчет производят через 3-4 мин после погружения по делению на шкале ареометра, соответствующему нижнему мениску жидкости (при отсчете глаз должен быть на уровне мениска). В случае определения темноокрашенных жидкостей отсчет производят по верхнему мениску.
При точном соблюдении правил приготовления эссенции по описаниям +отдельных §§ плотность основных настоек в среднем равен:
по §1 – 0,944
по §2 – 0,944
по §3 – 0,905
Ø определение содержания экстрактивных веществ (сухого остатка): выпаривают на водяной бане точно измеренное и точно взвешенное (с учетом плотности) количество жидкости, которое помещают в предварительно взвешенную фарфоровую чашку диаметром в 6-7 см. Затем сушат в течение 30 минут в термостате при 105°С.
Взвешивать следует по возможности быстрее, так как некоторые экстракты очень сильно поглощают влагу и поэтому масса их увеличивается на весах в течение нескольких минут. Также не следует сушить долее получаса, так как при длительной сушке при 105° С масса жиросодержащих сухих остатков вновь возрастает.
Содержание экстрактивных веществ (Х, %) рассчитывают по формуле:
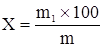 , где:
, где:
m – масса навески препарата до высушивания, г;
m1 – масса сухого остатка после высушивания, г;
Ø определение содержания жирных растительных масел: остаток, получаемый при определении содержания экстрактивных веществ, смачивают 1-2 мл воды (иногда с подогревом на водяной бане), а затем растирают до получения однородного порошка с 10,0 г прокаленного гипса. Массу помещают в гильзу из фильтровальной бумаги и накрывают ватным тампоном. Гильзу помещают в аппарат Сокслета и экстрагируют в течение 2–3 часов слегка кипящим петролейным эфиром. Затем эфир отгоняют, остаток сушат в течение 15 минут в сушильном шкафу при температуре 105° и взвешивают;
Ø количество обезжиренного сухого остатка определяют путём вычитания количества жирных масел из общего содержания сухого остатка.
Ø определение содержания нерастворимого в воде осадка в экстрагируемом остатке настоек и эссенций, приготовленных по §§1–3: 25,0 г эссенции выпаривают на водяной бане и непродолжительное время сушат в сушильном шкафу при температуре 105°С. После охлаждения остаток разбавляют водой, растирают и фильтруют через точно взвешенный фильтр и промывают водой. Затем фильтр высушивают и взвешивают.
Содержание нерастворимого осадка вычисляют по отношению к 100 частям экстрагируемого остатка настоек и эссенций.
Ø определение содержания этилового спирта:
а) по плотности отгона: в круглодонную колбу вместимостью 200–250 мл отмеривают точное количество жидкости (если жидкость содержит от 20 до 50% спирта – 50 мл, от 50% и выше – 25 мл; жидкость перед перегонкой разбавляют водой до 75 мл).
Для равномерного кипения в колбу с жидкостью помещают капилляры, пемзу или кусочки прокаленного фарфора. Если жидкость при перегонке сильно пенится, то добавляют фосфорную или серную кислоту (2–3 мл), хлорид кальция, парафин или воск (2–3 г).
Приёмник (мерную колбу вместимостью 50 мл) помещают в сосуд с холодной водой, собирают около 48 мл отгона, доводят его температуру до 20°С и добавляют воды до метки. Отгон должен быть прозрачным или слегка мутноватым.
Плотность отгона определяют пикнометром и по алкоголеметрическим таблицам находят соответствующее содержание спирта в процентах по объему и массе.
Содержание спирта в препарате (Х) в процентах по объёму вычисляют по формуле:
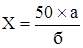 , где:
, где:
50 – объём отгона в миллилитрах;
а – содержание спирта в процентах по объёму;
б – объем исследуемого препарата, взятый для отгона, мл.
При содержании в жидкости эфирных масел, летучих кислот или оснований, камфоры к ней добавляют в делительной воронке равный объем насыщенного раствора натрия хлорида и такой же объем петролейного эфира. Смесь взбалтывают в течение 3 минут. После разделения слоёв спиртоводный слой сливают в другую делительную воронку и обрабатывают таким же образом половинным количеством петролейного эфира. Спиртоводный слой сливают в колбу для отгона, а соединённые эфирные жидкости взбалтывают с половинным количеством насыщенного раствора натрия хлорида, потом присоединяют к жидкости, находящейся в колбе для отгона.
При содержании летучих кислот их нейтрализуют раствором щелочи, при содержании летучих оснований – фосфорной или серной кислотой;
б) по температуре кипения настоек: прибор для количественного определения спирта в настойках состоит из сосуда для кипячения 1, трубки 2 с боковым отростком, холодильника 3, ртутного термометра 4 с ценой деления 0,1°С и пределом шкалы от 50 до 100°С (см. рис.).
 В сосуд для кипячения наливают 40 мл настойки и для равномерного кипения помещают капилляры, пемзу или кусочки прокаленного фарфора. Термометр помещают в приборе таким образом, чтобы ртутный шарик выступал над уровнем жидкости на 2–3 мм.
В сосуд для кипячения наливают 40 мл настойки и для равномерного кипения помещают капилляры, пемзу или кусочки прокаленного фарфора. Термометр помещают в приборе таким образом, чтобы ртутный шарик выступал над уровнем жидкости на 2–3 мм.
|
Полученный результат приводят к нормальному давлению. Если показания барометра отличаются от 1011 гПа (760 мм рт. ст.), вносят поправку на разность между наблюдаемым и нормальным давлением 0,04°С на 1,3 гПа (1мм рт. ст.). При давлении ниже 1011 гПа поправку прибавляют к установленной температуре, при давлении выше 1011 гПа поправку вычитают.
Содержание спирта в настойке определяют при помощи табл. 18.
Пример. Температура кипения настойки пустырника 80,9°С, атмосферное давление 1000 гПа (752 мм рт. ст.), разность давлений 1011 – 1000 = 11 гПа (760 – 752 = 8 мм рт. ст.). поправка составляет: 0,04°С × 8 = 0,32°С. К найденной температуре кипения прибавляют поправку: (80,9 + 0,32)°С. По табл. 18 этой температуре кипения соответствует 66% спирта.
Таблица 18
Определение концентрации спирта в водно-спиртовых смесях
по температуре кипения при давлении 1011 гПа (760 мм рт. ст.)
| Температура кипения, °С | % спирта по объему | Температура кипения, °С | % спирта по объему | Температура кипения, °С | % спирта по объему |
| 99,3 | 85,4 | 81,5 | |||
| 98,3 | 85,2 | 81,4 | |||
| 97,4 | 85,0 | 81,3 | |||
| 96,6 | 84,9 | 81,2 | |||
| 96,0 | 84,6 | 81,1 | |||
| 95,1 | 84,4 | 81,0 | |||
| 94,3 | 84,3 | 80,9 | |||
| 93,7 | 84,2 | 80,8 | |||
| 93,0 | 84,1 | 80,7 | |||
| 92,5 | 83,9 | 80,6 | |||
| 92,0 | 83,8 | 80,5 | |||
| 91,5 | 83,7 | 80,4 | |||
| 91,1 | 83,5 | 80,3 | |||
| 90,7 | 83,3 | 80,2 | |||
| 90,5 | 83,2 | 80,1 | |||
| 90,0 | 83,1 | 80,0 | |||
| 89,5 | 83,0 | 79,9 | |||
| 89,1 | 82,9 | 79,8 | |||
| 88,8 | 82,8 | 79,7 | |||
| 88,5 | 82,7 | 79,6 | |||
| 88,1 | 82,6 | 79,5 | |||
| 87,8 | 82,5 | 79,45 | |||
| 87,5 | 82,4 | 79,4 | |||
| 87,2 | 82,3 | 79,3 | |||
| 87,1 | 82,2 | 79,2 | |||
| 86,8 | 82,1 | 79,1 | |||
| 86,6 | 82,0 | 79,0 | |||
| 86,4 | 81,9 | 78,85 | |||
| 86,1 | 81,8 | 78,8 | |||
| 85,9 | 81,7 | 78,7 | |||
| 85,6 | 81,6 |
в) по показателю преломления жидкостей: в водных растворах этилового спирта линейная зависимость показателя преломления и концентрации наблюдается в пределах до 50-60%. При установлении крепости спирта в более концентрированных растворах следует их предварительно разбавить и при расчетах концентрации учитывать разведение.
Таблица 19
Показатели преломления спирто-водных растворов,
концентрация которых выражена в об. %
| Концентрация спирта | Показатель преломления при 20°С | Поправка показателя преломления на 1% спирта | Температурный коэффициент | Концентрация спирта | Показатель преломления при 20°С | Поправка показателя преломления на 1% спирта | Температурный коэффициент |
| 1,33300 | 1×10-4 | 1,34270 | 6,1×10-4 | 1,5×10-4 | |||
| 1,33345 | 4,5×10-4 | 1×10-4 | 1,34330 | 6,0×10-4 | 1,5×10-4 | ||
| 1,33400 | 5,5×10-4 | 1×10-4 | 1,34390 | 6,0×10-4 | 1,6×10-4 | ||
| 1,33444 | 4,4×10-4 | 1,1×10-4 | 1,34452 | 6,2×10-4 | 1,6×10-4 | ||
| 1,33493 | 4,9×10-4 | 1,1×10-4 | 1,34515 | 6,0×10-4 | 1,7×10-4 | ||
| 1,33535 | 4,2×10-4 | 1,2×10-4 | 1,34573 | 6,1×10-4 | 1,8×10-4 | ||
| 1,33587 | 5,2×10-4 | 1,2×10-4 | 1,34635 | 6,2×10-4 | 1,9×10-4 | ||
| 1,33641 | 5,4×10-4 | 1,3×10-4 | 1,34697 | 6,2×10-4 | 2,0×10-4 | ||
| 1,33700 | 5,9×10-4 | 1,3×10-4 | 1,35000 | 6,0×10-4 | 2,0×10-4 | ||
| 1,33760 | 6,0×10-4 | 1,3×10-4 | 1,35320 | 6,4×10-4 | 2,1×10-4 | ||
| 1,33808 | 4,8×10-4 | 1,4×10-4 | 1,35500 | 4,0×10-4 | 2,4×10-4 | ||
| 1,33870 | 6,2×10-4 | 1,4×10-4 | 1,35700 | 4,0×10-4 | 2,4×10-4 | ||
| 1,33924 | 5,4×10-4 | 1,4×10-4 | 1,35900 | 4,0×10-4 | 2,6×10-4 | ||
| 1,33977 | 5,3×10-4 | 1,4×10-4 | 1,36060 | 3,2×10-4 | 2,6×10-4 | ||
| 1,34043 | 6,6×10-4 | 1,4×10-4 | 1,36180 | 2,4×10-4 | 3,4×10-4 | ||
| 1,34096 | 5,3×10-4 | 1,5×10-4 | 1,36300 | 2,4×10-4 | 3,6×10-4 | ||
| 1,34158 | 6,2×10-4 | 1,5×10-4 | 1,36380 | 1,6×10-4 | 3,8×10-4 | ||
| 1,34209 | 5,1×10-4 | 1,5×10-4 | 1,36450 | 1,4×10-4 | 4,0×10-4 |
При определении показателя преломления спирто-водных растворов следует на призму рефрактометра наносить не менее 5-7 капель и измерять величину n немедленно во избежание ошибки, связанной с летучестью спирта. Исследование необходимо проводить при температуре 20°С. Если оно осуществляется не при 20°С, следует вносить поправки на температуру. Величины поправок показателя преломления на 1°С представлены в табл.19. Если определение проводится при температуре выше 20°С, то поправку прибавляют к найденной величине показателя преломления; если анализ проводится при температуре ниже 20°С, поправку вычитают.
Пример. Анализу подвергался 40% спиртовой раствор. Определение показателя преломления проводили при 23°С. Показание рефрактометра – 1,3541. Согласно табл.19 поправка на 1°С для показателя преломления, близкого по величине к полученному (1,35500), равна 2,4×10-4 (т. е. 0,00024). Поскольку исследование проводилось при 23°С, то поправка будет составлять 0,00024 × 3 = 0,00072. Показатель преломления, приведенный к 20°С, равен 1,3541 + 0,00072 = 1,35482.
По табл.19 определяют соответствующую данному показателю преломления концентрацию спирта. Найденной величины показателя преломления (1,35482) в таблице нет; близкому по величине показателю преломления 1,35500 соответствует 40% спирт. Необходимо определить, какая концентрация спирта соответствует разности показателей преломления: 1,35500 – 1,35482 = 0,00018. Поправка на 1% спирта равна 4,0×10-4. Следовательно, 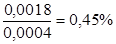 . Таким образом, истинное содержание спирта в исследуемом растворе 40 – 0,45 =39,55%.
. Таким образом, истинное содержание спирта в исследуемом растворе 40 – 0,45 =39,55%.
Для определения концентрации этилового спирта в спиртовых растворах лекарственных препаратов, приготовленных на 70% спирте, разбавление проводят обычно 1:2, а приготовленных на 90% и 95% спирте, – 1:3. При этом необходимо учитывать, что при смешивании спирта с водой объем раствора несколько уменьшается, в связи с чем следует вносить поправку к фактору разведения: при смешивании 1 мл спирта с 2 мл воды умножают коэффициент 2,98 (вместо 3); при смешивании 1 мл спирта с 3 мл воды – на 3,93 (вместо 4).
Пример. Анализировали настойку барбариса, приготовленную по §4 на 70% спирте; определение проводили при 20°С. По показаниям рефрактометра n = 1,34555. В табл.12 данная величина показателя преломления отсутствует, наиболее близким значением является 1,34573, что соответствует 23% концентрации спирта. Разность показателей преломления составляет: 1,34573 – 1,34555 = 0,00018. Поправка на 1% спирта по табл.12 равна 6,1×10-4, следовательно, разности показаний соответствует концентрация спирта  . Так как перед определением настойку разводили 1:2, истинная концентрация составляет (23 – 0,295) × 1,98 = 67,66%.
. Так как перед определением настойку разводили 1:2, истинная концентрация составляет (23 – 0,295) × 1,98 = 67,66%.
г) по плотности жидкости, определенной с помощью ареометра: по алкоголеметрическим таблицам ГФ находят соответствующее содержание спирта в процентах по массе и по объему;
Ø определение содержания тяжелых металлов: в фарфоровой чашке упаривают досуха 5 мл жидкого исследуемого препарата, затем остаток осторожно сжигают в присутствии серной кислоты и прокаливают. Полученный остаток обрабатывают при нагревании 5 мл насыщенного раствора аммония ацетата, фильтруют через беззольный фильтр и доводят до метки 100 мл. 10 мл полученного раствора должны выдерживать испытания на тяжелые металлы (не более 0,001%).
Для контроля качества порошковых растираний (тритураций) проводят следующие определения:
Ø равномерность распределения лекарственных веществ в тритурациях: порошки рассматривают на расстоянии 20–25 см с помощью лупы или микроскопа с окулярным микрометром в прямом свете: лекарственное вещество должно быть равномерно распределено в молочном сахаре;
Ø соответствие окраски, вкуса, запаха: в низких разведениях у окрашенных, сильно пахнущих и имеющих резкий вкус исходных веществ можно заметить соответствующую окраску и почувствовать своеобразный запах или вкус;
Ø однородность: основная масса готовой тритурации должна состоять из частиц размером 25 мкм и менее, не должно быть частиц размером более
50 мкм;
Ø величина внешней удельной поверхности тритурации должна быть не менее 0,65 м2/г, а молочного сахара – не менее 0,50 м2/г;
Ø размер частиц металлических и угольных растираний: на предметное стекло наносят 0,02-0,03 г соответствующего растирания, добавляют 1-2 капли воды и вызывают растворение молочного сахара умеренным нагреванием; затем (при не очень высокой температуре) раствор выпаривают настолько, чтобы остался вязкий, олифоподобный остаток, который накрывают покровным стеклом. Препарат рассматривают под микроскопом при увеличении в 200 раз, а величину непрозрачных металлических частичек определяют с помощью окулярного микрометра;
Ø капиллярный анализ: растирания берут в количестве 5 г, смешивают примерно с двойным весовым количеством абсолютного этилового спирта и полученную смесь подвергают капиллярному анализу как жидкое разведение;
Ø перекристаллизация насыщенных растворов: взвешенную пробу вещества помещают в мерную колбу с определенным количеством воды, различным для каждого вещества, а колбу покрывают небольшим кристаллизатором. Растворения достигают нагреванием закрытой колбы в кипящей воде или на открытом пламени, затем медленно охлаждают на воздухе:
а) с веществами, пересыщенные растворы которых полностью кристаллизуются при соприкосновении с изоморфным кристаллом, поступают следующим образом: небольшой пипеткой осторожно берут несколько капель пересыщенного раствора и помещают по одной на стеклянную пластинку, затем небольшим, предварительно прокаленным, а затем полностью охлажденным платиновым шпателем берут небольшую пробу (приблизительно величиной с булавочную головку) растирания, подлежащего испытанию, и помещают ее в одну из капель пересыщенного раствора, находящегося на стеклянной пластинке. Если в пробе был хоть один изоморфный кристалл, то сравнительно быстро происходит кристаллизация всей капли, в результате чего образуется грубая кристаллическая поверхность и одновременно теряется ее прозрачность. Примером этого класса веществ являются натрия ацетат и сегнетова соль;
б) вещества, пересыщенные растворы которых, соприкасаясь с изоморфным кристаллом, увеличивают его, а сами при этом не кристаллизуются: с помощью пипетки берут несколько миллилитров пересыщенного раствора и осторожно, так, чтобы не смочить край и верхнюю поверхность стенки, помещают в маленькую пробирку, закрываемую резиновой пробкой. С помощью маленького, предварительно прокаленного и полностью охлаждённого платинового шпателя, добавляют к раствору небольшую пробу исследуемого растирания, пробирку закрывают резиновой пробкой, осторожно опрокидывают и оставляют в наклонном положении на несколько часов. Если в пробе были микроскопические изоморфные кристаллы, то через несколько часов на нижней стенке можно заметить некоторое количество выросших кристаллов или друз различной величины. Примером этого класса веществ являются бура и меди сульфат.
Примечание: у растираний веществ, которые в пересыщенных растворах могут вызывать явление перекристаллизации, этот метод можно использовать для проверки приготовления лекарства согласно прописи, т.к. явление перекристаллизации наблюдается и при высоких разбавлениях, например, таких как с 5 до 9 десятичные растирания.
Аналитический контроль* качества основных гомеопатических препаратов по действующим веществам проводят различными методами в зависимости как от природы исходных веществ, так и от того являются ли они фармакопейными или не фармакопейными препаратами.
Фармакопейные аллопатические препараты, которые применяются также в гомеопатии, анализируют на подлинность и количественное содержание по методикам фармакопейных изданий. В качестве примеров можно привести некоторые химические соединения, применяемые для приготовления растворов или порошковых растираний:
меди сульфат (CuSO4 ·5H2O)
подлинность: реакция с железом металлическим (проба на Cu2+);
реакция с аммиаком (проба на Cu2+);
реакция с бария нитратом (проба на SO42–);
количественное определение:
субстанция – йодометрическое определение;
тритурации, дилюции – йодометрическое определение – до Х3;
фотоколориметрически с аммиаком – до Х4;
калия карбонат (K2CO3)
подлинность: реакция с винной кислотой (проба на K+);
реакция с хлороводородной кислотой (проба на CO32-);
количественное определение:
субстанция – кислотно-основное титрование;
тритурации, дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование;
прямая потенциометрия;
натрия карбонат (Na2CO3)
подлинность: реакция с цинкуранил ацетатом (проба на Na+);
реакция с хлористоводородной кислотой (проба на CO32-);
количественное определение:
субстанция – кислотно-основное титрование;
тритурации, дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование;
прямая потенциометрия;
бура, натрия тетраборат (Na2B4O7 ·10H2O)
подлинность: реакция образования борноэтилового эфира;
количественное определение:
субстанция – кислотно-основное титрование;
тритурации, дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование;
прямая потенциометрия;
натрия гидрокарбонат (NaHCO3)
подлинность: реакция с цинкуранил ацетатом (проба на Na+);
реакция с хлористоводородной кислотой (проба на CO32–);
реакция с магния сульфатом (проба на HCO3–);
количественное определение:
субстанция – кислотно-основное титрование;
тритурации, дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование;
прямая потенциометрия;
натрия хлорид (NaCl)
подлинность: реакция с цинкуранил ацетатом (проба на Na+);
реакция с серебра нитратом (проба на Cl–);
количественное определение:
субстанция – аргентометрическое определение по Мору;
тритурации, дилюции до Х3 – аргентометрическое титрование;
потенциометрическое титрование;
прямая потенциометрия;
магния сульфат (MgSO4 ·7H2O)
подлинность: реакция с натрия гидрофосфатом в аммиачном буфере (проба на Mg2+);
реакция с бария нитратом (проба на SO42–);
количественное определение:
субстанция – комплексонометрическое титрование;
тритурации, дилюции до Х3 – аналогично;
кислота хлористоводородная (HCl)
подлинность: определение рН (проба на H+)
реакция с серебра нитратом (проба на Cl–);
количественное определение:
субстанция – кислотно-основное титрование;
дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование;
кислота уксусная (CH3COOH)
подлинность: определение рН (проба на H+)
реакция со спиртом этиловым (проба на ацетат-ион);
количественное определение:
субстанция – кислотно-основное титрование;
тритурации, дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование;
прямая потенциометрия;
железа сульфат (FeSO4 ·H2O)
подлинность: реакция с калия гексацианоферратом (III) K3[Fe(CN)6] (проба на Fe2+);
реакция с бария нитратом (проба на SO42–);
количественное определение:
субстанция – перманганометическое титрование;
тритурации, дилюции до Х3 – аналогично;
серебра нитрат (AgNO3)
подлинность: реакция с хлористоводородной кислотой (проба на Ag+)
количественное определение:
субстанция – прямое тиоцианатометрическое титрование по Фольгарду;
тритурации, дилюции до Х3 – прямое тиоцианатометрическое титрование по Фольгарду;
прямая ионометрия;
железо металлическое (Fe)
получение: восстановление водородом из железа (II) оксида;
подлинность: растворение в серной кислоте и реакция на Fe2+ действием калия гексацианоферрата (III) K3[Fe(CN)6;
количественное определение:
субстанция – растворение в серной кислоте, затем перманганометрическое титрование;
тритурации до Х3 – аналогично.
Если препарат не является фармакопейным, то в качестве субстанций используют химические реактивы квалификации не менее «ч. д. а.». Их качество должно соответствовать ГОСТу на данный химический реактив и подтверждаться стандартными методиками.
Для примера можно привести следующие препараты:
цинк (Zn) марки «ч. д. а.» либо полученный электролизом раствора
цинка сульфата;
подлинность: растворение без остатка в хлористоводородной кислоте;
количественное определение:
субстанция – комплексонометрическое титрование;
тритурации – комплексонометрическое титрование – до Х3;
фотоколориметричеси с дитизоном – до Х5;
серебро (Ag)
подлинность: растворение без остатка в азотной кислоте;
субстанция – растворение в азотной кислоте, затем прямое тиоцианатометрическое титрование по Фольгарду;
тритурации до Х3 – аналогично;
свинец (Pb)
подлинность: растворение без остатка в азотной кислоте;
количественное определение:
субстанция – растворение в азотной кислоте, затем комплексонометрическое титрование;
тритурации до Х3 – аналогично;
кислота азотная (HNO3)
подлинность: определение рН (проба на H+)
реакция с железа сульфатом и серной кислотой (проба на NO3–) или реакция с дифениламином (проба на NO3–);
количественное определение:
субстанция – кислотно-основное титрование;
дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование;
кислота серная (H2SO4)
подлинность: определение рН (проба на H+)
реакция с бария нитратом (проба на SO42–);
количественное определение:
субстанция – кислотно-основное титрование;
дилюции до Х3 – кислотно-основное титрование;
потенциометрическое титрование.
В случае отсутствия соответствующих химических реактивов, субстанции получают особыми (специальными) методами. Например:
кальциум карбоникум, кальция карбонат (CaCO3)
получение: белоснежные внутренние чешуйчатые кусочки разбитых раковин превращают в мелкий порошок;
подлинность: растворение в азотной кислоте и реакция с молибденовокислым аммонием (проба на Ca2+);
количественное определение:
субстанция, тритурации – не стандартизуются;
алюмина, обожжённый глинозём (Al2O3)
получение: из криолита или из раствора алюминиево-калиевых квасцов под действием аммиака;
подлинность: щелочное плавление, затем реакция с ализарином (проба на Al3+);
количественное определение:
субстанция, тритурации – не стандартизуются;
калия арсенит (KAsO2·HAsO2·H2O)
получение: реакция мышьяковистого ангидрида с калия карбонатом;
подлинность: реакция с сероводородом, реакция с серебра нитратом (пробы на AsO2–);
количественное определение:
субстанция – иодометрически;
броматометрически;
тритурации до Х3 – иодометрически;
хлористое золото, тетрахлороаурат (III) водорода (H[AuCl4]·H2O)
получение: растворение золота в царской водке (смеси хлороводородной и азотной кислот);
подлинность: реакция с молочным сахаром и раствором формальдегида (проба на Au3+);
количественное определение:
субстанция, дилюции до Х6 – фотоколориметрически с толуидиновым реактивом.
Контроль качествабазисных гомеопатических препаратов из растительного сырья (эссенции, настойки) с целью их дальнейшей стандартизации также рекомендуется проводить по содержанию биологически активных веществ. Для этого используют:
Ø качественные реакции на основные группы биологически активных соединений;
Ø хроматографический анализ в различных системах растворителей;
Ø количественное определение инструментальными (газожидкостная хроматография, УФ- и ИК-спектрофотометрия, фотоколориметрия) и другими методами.
Широко распространёнными в растительном сырье классами соединений являются: алкалоиды, кардиотонические (сердечные) гликозиды, флавоноиды, сапонины, дубильные вещества, антраценпроизводные, кумарины, витамины, полисахариды и др. Для обнаружения основных групп биологически активных веществ (БАВ) в растительном сырье и препаратах наиболее часто используют цветные качественные реакции или реакции осаждения.
Алкалоиды обнаруживают следующими общими осадочными реакциями:
þ с реактивом Майера (растворы ртути дихлорида и калия йодида) – бурый осадок;
þ с реактивами Вагнера и Бушарда (растворы йода в растворе калия йодида) – бурый осадок;
þ с реактивом Драгендорфа (раствор висмута нитрата основного, калия йодида и кислоты уксусной) – оранжево-красный или кирпично-красный осадок;
þ с реактивом Марме (раствор кадмия йодида и калия йодида) – белый или желтоватый осадок;
þ с реактивом Зонненшейна (раствор фосфорномолибденовой кислоты) – желтоватый осадок;
þ с раствором кремневольфрамовой кислоты – беловатый осадок;
þ с раствором пикриновой кислоты – жёлтый осадок;
þ с раствором танина –беловатый или желтоватый осадок.
При определении кардиотонических гликозидов проводят цветные реакции на различные фрагменты молекулы:
на стероидную часть молекулы карденолида:
þ реакцию Либермана-Бурхарда (ледяная уксусная кислота, уксусный ангидрид и концентрированная серная кислота) – на границе слоёв окраска от розовой до зелёной и синей;
þ реакция Розенгейма (спиртовый раствор трихлоруксусной кислоты) – окраска от розовой до лиловой и синей;
на бутенолидное (лактонное) кольцо:
þ реакция Раймонда (бензольный раствор м-динитробензола и спиртовый раствор калия гидроксида);
þ реакция Легаля (растворы нитропруссида натрия и натрия гидроксида) – на границе слоёв красное окрашивание в виде кольца;
þ на сахарный компонент:
þ реакция Келлер-Килиани (ледяная уксусная кислота со следами железа сульфата и концентрированная серная кислота) – верхний слой окрашивается в васильково-синий цвет;
þ реакция с реактивом Фелинга – оранжевый осадок после гидролиза.
Последняя из указанных реакций используется также для определения восстанавливающих сахаров.
Наличие флавоноидов устанавливают с помощью таких реакций:
þ цианидиновая проба (порошок металлического магния и концентрированная хлороводородная кислота) – флавоны, флавонолы и флавононы дают красное или оранжевое окрашивание;
þ борно-лимонная реакция – 5-оксифлавоны и 5-оксифлавонолы образуют ярко-жёлтое окрашивание с жёлто-зелёной флуоресценцией;
þ реакция с трёххлористой сурьмой – 5-оксифлавоны и 5-оксифлавонолы дают жёлтое или красное окрашивание;
þ реакции с раствором аммиака или спиртоводным раствором натрия (калия) гидроксида – флавоны, флавонолы, флавононы и флавононолы образуют жёлтое окрашивание, при нагревании переходящее в оранжевое или красное; халконы и ауроны дают сразу красное или пурпурное окрашивание;
þ реакция с хлоридом окисного железа – при наличии полифенолов появляется зеленовато-синее окрашивание;
þ реакция с раствором ванилина в концентрированной хлороводородной кислоте – катехины дают красно-малиновое окрашивание;
þ реакция со средним ацетатом свинца – флавоны, халконы, ауроны, содержащие свободные ортогидроксильные группировки в кольце В, образуют осадки, окрашенные в ярко-жёлтый и красный цвета.
Для обнаружения сапонинов и установления их химической природы используют следующие реакции:
þ проба на пенообразование (в присутствии кислоты и щёлочи) – равная по объёму и стойкости пена образуется в обеих пробирках при наличии тритерпеновых сапонинов; в случае содержания сапонинов стероидной природы в щелочной среде образуется пена в несколько раз больше по объёму и стойкости;
þ реакция со спиртовым раствором холестерина – обе группы сапонинов образуют осадки;
þ реакция с баритовой водой – обе группы сапонинов дают осадки;
þ реакция с растворами ацетата свинца – тритерпеновые сапонины осаждаются средним ацетатом свинца, а стероидные – основным;
þ реакция Либермана-Бурхарда – стероидные сапонины (как и сердечные гликозиды) дают окраску от розовой до зелёной и синей;
þ реакция Лафона (раствор меди сульфата и концентрированная серная кислота) – при нагревании появляется сине-зелёное окрашивание;
þ реакция Сальковского (хлороформ и концентрированная серная кислота) – наблюдается появление окраски от жёлтой до красной;
þ реакция с пятихлористой сурьмой (хлороформный раствор) – появляется красное окрашивание, переходящее в фиолетовое;
þ реакция с раствором натрия нитрата (в присутствии концентрированной серной кислоты) – ярко-красное окрашивание;
þ реакция с ванилином (спиртовый раствор) и концентрированной серной кислотой – появляется красное окрашивание, при разбавлении водой тритерпеноиды образуют синие хлопья.
Наличие кумаринов можно обнаружить с помощью:
þ реакции со щёлочью и диазотированной сульфаниловой кислотой – при нагревании с раствором калия гидроксида раствор желтеет, а после добавления диазотированной сульфаниловой кислоты окраска изменяется от коричнево-красного до вишнёвого цвета;
þ лактонной пробы: после нагревания препарата со спиртовым раствором калия гидроксида, разбавления водой очищенной и добавления хлороводородной кислоты помутнение или выпадение осадка указывает на вероятное наличие кумаринов.
Обнаружение дубильных веществ проводят следующими качественными реакциями:
þ с раствором желатина – образование мути;
þ с раствором хинина гидрохлорида – аморфный осадок;
þ с растворами железо-аммониевых квасцов или хлорида окисного железа появляется окрашивание: чёрно-синее – при наличии гидролизуемых дубильных веществ, и чёрно-зелёное – в присутствии конденсированных;
þ с бромной водой – при наличии конденсированных дубильных веществ сразу образуется осадок;
þ с раствором средней соли свинца ацетата в уксуснокислой среде – осадок выпадает при наличии гидролизуемых дубильных веществ; при добавлении к фильтрату раствора железо-аммониевых квасцов и кристаллического натрия ацетата в присутствии конденсированных дубильных веществ появляется чёрно-зелёное окрашивание;
þ с кристаллическим натрия нитратом в присутствии хлороводородной кислоты – при наличии гидролизуемых дубильных веществ появляется коричневое окрашивание.
Другие классы соединений определяют отдельными специфическими качественными реакциями, описание которых изложено в методических материалах по химическому анализу лекарственных растений (Гринкевич Н. И., Сафронич Л. Н., М, 1983; Ковалёв В. Н., Солодовниченко Н. М., Харьков, 1987).
Для хроматографического анализа алкалоидов используют следующие системы растворителей:
а) для хроматографии на бумаге: н-бутанол – уксусная кислота – вода (5:1:4); этилацетат – уксусная кислота – вода (11:21:85); н-бутанол, насыщенный водой – ледяная уксусная кислота (100:5) и др.;
б) для тонкослойной хроматографии: хлороформ – ацетон – диэтиламин (5:4:1); хлороформ – диэтиламин (9:1); хлороформ – метанол – уксусная кислота (18:1:1); хлороформ – этанол (9:1) или (8:2); ацетон – раствор аммиака (95:5).
Проявителями для хроматограмм служат реактив Драгендорфа, пары йода, хлороформный раствор сурьмы трихлорида.
Обнаружение кардиотонических (сердечных) гликозидов методами ТСХ и хроматографии на бумаге проводят в системах: хлороформ – ацетон – вода (84:15:0,7); хлороформ – бензол – н-бутанол (78:12:5); этилацетат – бензол – вода (84:16:50); бензол – хлороформ (9:1), (7:5) или (3:7).
Для проявления хроматограмм используют реактивы Раймонда (растворы м-динитробензола и калия гидроксида спиртовый) или Йенсена (25%-хлороформный раствор трихлоруксусной кислоты).
Для обнаружения флавоноидов методом хроматографии на бумаге и в тонком слое сорбента рекомендуемые системы растворителей: 15% уксусная кислота; н-бутанол – уксусная кислота – вода (4:1:2); этилацетат – муравьиная кислота – вода (70:15:17) или (10:2:3); метанол – уксусная кислота – вода (18:1:1) и др.
В качестве проявителей используют: 1% спиртовый раствор алюминия хлорида, 10% спиртовый раствор натрия (калия) гидрооксида, пары аммиака в УФ-свете и т. д.
Дубильные вещества методом ТСХ чаще всего анализируют в системе: н-бутанол – уксусная кислота – вода (40:12:28) и обрабатывают 1% раствором ванилина в концентрированной хлороводородной кислоте.
Хроматографирование сапонинов в тонком слое сорбента проводят в системах бензол – метанол (8:2); хлороформ – метанол – вода (61:32:7); изопропанол – вода – хлороформ (30:10:5); хлороформ – метанол (3:1); н-бутанол – этанол – 25% раствор аммиака (7:2:5) и др.
Проявление хроматограмм проводят соответственно парами йода, 20% раствором серной кислоты и 10% спиртовым раствором фосфорновольфрамовой кислоты.
Для анализа кумаринов предлагают такие системы растворителей:
а) для хроматографии на бумаге: петролейный эфир – бензол – метанол (5:4:1);
б) в тонком слое: бензол – этилацетат (2:1); ацетон – гексан (2:8); гексан – бензол – метанол (5:4:1).
Обработку хроматограмм проводят 10% раствором калия гидроксида и диазотированной сульфаниловой кислотой.
Кроме того, методами хроматографии обнаруживают такие классы химических соединений:
каротиноиды – системы: хлороформ – ацетон (9:1); бензол – метанол (1:1) и др.; реактивы для проявления хроматограмм – 10% спиртовый раствор фосфорномолибденовой кислоты, пары йода;
антраценпроизводные –системы: этилацетат – муравьиная кислота – вода (10:2:3), этилацетат – метанол – вода (100:17:13); реактив для проявления хроматограмм – 5% спиртовый раствор гидроксида калия (натрия);
аминокислоты – системы: бутанол – уксусная кислота – вода (4:1:1), этанол – вода (95:5), изопропанол – аммиак – вода (10:1:1), изопропанол – уксусная кислота – вода (7:2:1), н-бутанол – муравьиная кислота – вода (75:15:10); реактив для проявления хроматограмм – 0,2% спиртовый или бутанольный раствор нингидрина.
Примеры хроматограмм в тонком слое и на бумаге приведены на рисунке.
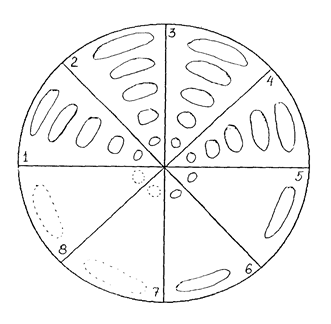
| 
| |||
| Примеры схем хроматографии флавоноидов: | ||||
| а) – круговая бумажная хроматография: 1–эссенция туи; 2–тинктура из эссенции; 3–тинктура из свежего сырья; 4–тинктура из сухого сырья; 5–разведение Х2 из тинктуры (из эссенции); 6–разведение Х3 из тинктуры (из свежего сырья); 7–разведение Х3 (тинктура из сухого сырья); 8–гранулы Х3 (тинктура из свежего сырья); | б) – хроматография в тонком слое сорбента: 1–эссенция; 2–тинктура из эссенции; 3–тинктура из свежего сырья; 4–тинктура из сухого сырья; | |||
| Система: 15% уксусная кислота; Проявители: пары аммиака, спирто-водный раствор калия гидроксида, УФ-свет | ||||
Количественное содержание БАВ в матричных настойках и других базисных препаратах в частных статьях фармакопей зарубежных стран указывается лишь в редких случаях, в частности при анализе настоек, содержащих ядовитые и сильнодействующие вещества (аконит, строфант, чилибуха, игнация, белладонна и др.).
В нормативные документы, предназначенные для гомеопатической фармакопеи Российской федерации, включены современные методы анализа, позволяющие осуществлять контроль качества гомеопатических лекарственных средств с учётом содержания БАВ.
Для этой цели можно использовать газожидкостную хроматографию, спектрофотометрию, фотоколориметрию и другие инструментальные методы, в некоторых случаях целесообразно использовать титриметрические методы анализа.
Дата добавления: 2015-10-13; просмотров: 3549;
