термодинамики
Теплоемкость и ее виды. Удельной теплоемкостью с называют количество теплоты q, которое требуется для изменения температуры единицы количества вещества на один градус: с = q/DT; с = dq/dT.
В зависимости от способа измерения единицы количества вещества, характера термодинамического процесса и величины интервала температур различают несколько видов теплоемкостей.
1. В зависимости от единицы количества вещества – 1 кг, 1 м3, 1 кмоль – теплоемкость бывает массовой с [Дж/(кг×К)], объемной с' [Дж/(м3×К)] и молярной µс [Дж/(кмоль×К)].
Связь между ними выражается зависимостью
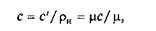
где rн — плотность вещества при нормальных физических условиях.
Количество теплоты определяется по формуле
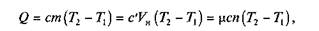
где т —- масса газа; Vн— объем газа, приведенный к нормальным физическим условиям; п— число молей газа.
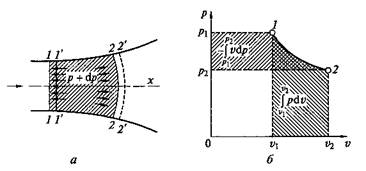
Рис. 2.2. Внешняя работа движущегося газа (а)и графическое изображение технической работы на р—v-диаграмме (б)
2. Теплоемкость зависит от характера процесса и свойств газа. В зависимости от способа подвода теплоты различают теплоемкость при постоянном давлении (изобарную) ср и теплоемкость при постоянном объеме (изохорную) cv.
Еще в 1842 г. один из основоположников закона сохранения и превращения энергии Ю. Р. Майер установил, что
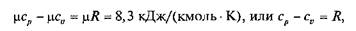
где R — газовая постоянная,
Отношение k = cp/cv называют показателем адиабаты.
3. Поскольку теплоемкость изменяется с температурой, в зависимости от интервала температур различают истинную с и среднюю ст удельные теплоемкости. Истинной называют теплоемкость с = dq/dT, соответствующую бесконечно малому интервалу температур, а средней — теплоемкость ст = q/(T2– T1), соответствующую конечному интервалу изменения температуры.
При практических расчетах обычно пользуются табличными данными средних теплоемкостей в интервале температур от 0 до t°C. В этом случае количество теплоты, требующееся для нагрева 1 кг рабочего тела от 0 до t1или до t2:
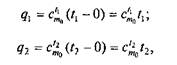
где сt1mо и сt2mо — табличные значения теплоемкостей в интервалах температур (0...t1)и (0...t2).
Количество теплоты, необходимое для нагрева 1 кг тела от t1до t2, определяется следующим образом:
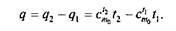
Энтальпия. В ряде случаев оказывается целесообразным объединение параметров и и pv в общий калорический параметр, называемый энтальпией, Дж/кг:

Энтальпия – термодинамическая функция, имеющая смысл полной (внутренней и внешней) энергии системы. Она складывается из внутренней энергии и и упругостной энергии pv, обусловленной наличием внешнего давления окружающей среды р, т.е. pv – работа, которую надо затратить, чтобы ввести рабочее тело объемом v в среду, имеющую давление р.
Для идеального газа справедливы соотношения:
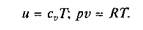
Продифференцировав выражение i = и + pv и подставив в дифференциальное уравнение первого икона термодинамики (2.4), для потока рабочего тела можно получить:
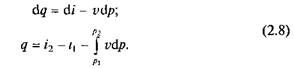
Энтальпия измеряется в тех же единицах, что и теплота, работa и внутренняя энергия (Дж/кг).
Второй закон термодинамики. Второй закон термодинамики, как и первый, является опытным законом, основывающимся на многовековых наблюдениях ученых. Однако установлен он был только в середине XIX в.
Наблюдения за явлениями природы показывают, что возникновение и развитие самопроизвольно протекающих в ней естественных процессов, работа которых может быть использована для нужд человека, возможно лишь при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой. Эти процессы всегда характеризуются односторонним их протеканием от более высокого потенциала к более низкому (от более высокой температуры к более низкой или от более высокого давления к более низкому). При протекании указанных процессов термодинамическая система стремится к тому, чтобы прийти в равновесие с окружающей средой, характеризуемое равенством давления и температуры системы и окружающей среды.
Из наблюдений за явлениями природы следует также, что для того чтобы заставить процесс протекать в направлении, обратном направлению протекания самопроизвольного процесса, необходимо затратить заимствуемую из внешней среды энергию.
Второй закон термодинамики представляет собой обобщение изложенных выше положений и заключается в следующем.
1. Самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой.
2. Самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении от более высокого потенциала к более низкому.
3. Ход самопроизвольно протекающих процессов происходит в направлении, приводящем к установлению равновесия термодинамической системы с окружающей средой, и по достижении этого равновесия процессы прекращаются.
4. Процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого заимствуется из внешней среды.
Из второго закона термодинамики вытекает следующее: для того чтобы работала периодически действующая машина, необходимо, чтобы были минимум два источника теплоты различной температуры; при этом в работу может быть превращена лишь часть теплоты, забираемой из высокотемпературного источника, в то время как другая часть теплоты должна быть передана низкотемпературному источнику.
Энтропия.В термодинамике пользуются еще одним параметром состояния рабочего тела — энтропией, устанавливающей связь между количеством теплоты и температурой (Р. Клаузиус, 1850 г.). Поясним этот параметр исходя из следующих соображений.
Уравнение первого закона термодинамики можно записать в виде
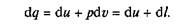
В этом уравнении dq не является полным дифференциалом, поскольку в правую часть уравнения входит член dI, не являющийся полным дифференциалом, так как работа является не параметром состояния газа, а функцией процесса.
Из математики известно, что всякий двучлен можно представить в виде полного дифференциала, если его умножить на так называемый интегрирующий множитель.
При умножении на интегрирующий множитель 1/Т (где Т — абсолютная температура) приведенное выше уравнение примет вид

Уравнение (2.9) можно представить в несколько ином виде, а именно:
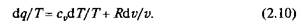
Выражение (2.10) говорит о том, что dq/T представляет собой полный дифференциал некоторой функции s (т.е. dq/T=ds), являющейся параметром состояния газа, поскольку она зависит только от двух параметров состояния газа и поэтому не зависит от того, каким путем газ из одного состояния перешел в другое. Этот параметр состояния газа в общем случае называют энтропией газа, обозначают буквой S (Дж/К). Энтропию, отнесенную к 1 кг газа, называют удельной энтропией газа и обозначают буквой s [Дж/(кг К)].
Следовательно, можно записать:
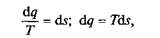
или полное количество теплоты в термодинамическом процессе

Этот интеграл можно вычислить, если известна функциональная зависимость между Т и s. Пользуясь этой зависимостью, в координатах Т, s строят кривые, отображающие те или иные термодинамические процессы.
На основании выражения (2.11) можно заключить, что для процесса 1–2 (рис. 2.3) площадь 1–2–s2–s1,лежащая под кривой, отображающей этот процесс, выражает количество теплоты, участвующее в этом процессе.
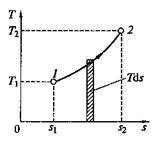
Рис. 2.3. Графическое изображение подвода теплоты на Т– s-диаграмме
Физический смысл энтропии.Энтропию нельзя измерить, ее смысл затруднительно продемонстрировать с помощью наглядных пособий, но можно понять по следующим интерпретациям.
1. Энтропия – мера ценности теплоты, ее работоспособности и технологической эффективности.
2. Энтропия – мера потери работы вследствие необратимости реальных процессов. Чем более необратим процесс в изолированной системе, тем больше возрастает энтропия (s2 >> s1)и тем большая доля энергии не превращается в работу, рассеивается в окружающую среду.
3. Энтропия – мера беспорядка. Если установить некоторую меру неупорядоченности макросистемы — неупорядоченности расположения и движения частиц D, то можно записать s = k ln D, где к — коэффициент пропорциональности.
Следовательно, возрастание беспорядка означает возрастание энтропии, рассеивание энергии. При подводе теплоты увеличивается хаотичность теплового движения частиц и энтропия возрастает. Охлаждение системы при постоянном объеме есть извлечение из нее теплоты, а следовательно, и энтропии. Упорядоченность системы при этом повышается, а энтропия уменьшается. Такая закономерность позволяет предположить, что если абсолютная температура станет равной нулю и тепловое движение полностью прекратится, то в системе установится максимальный порядок, т.е. неупорядоченность и энтропия станут равными нулю. Это предположение, не поддающееся опытной проверке, ибо абсолютный нуль температуры недостижим, носит название третьего закона термодинамики. Следовательно,
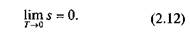
Обратимые термодинамические процессы.Для исследования термодинамических процессов вводят понятия о равновесных (обратимых) процессах. Состояние рабочего тела, при котором давление, температура и, следовательно, удельный объем во всех его точках не изменяются без внешнего энергетического воздействия во времени, называется равновесным состоянием.
Последовательное изменение состояния рабочего тела, происходящее в результате энергетического взаимодействия рабочего тела с окружающей средой, называется термодинамическим процессом. Процесс, при осуществлении которого тело последовательно проходит непрерывный ряд состояний равновесия, называется равновесным.
Обратимым процессом называется такой термодинамический процесс, который допускает возможность протекания через одни и те же равновесные состояния как в прямом, так и в обратном направлениях, а в окружающей среде не остается никаких изменений.
В природе и технике обратимые процессы в чистом виде не наблюдаются. Однако их изучение играет большую роль, так как многие реальные процессы близки к обратимым.
2.4. Основные термодинамические процессы идеальных газов
Виды процессов. Основными процессами в технической термодинамике, весьма важными и в теоретическом, и в прикладном отношениях, являются:
изохорный — протекающий при постоянном объеме;
изобарный — протекающий при постоянном давлении;
изотермический — происходящий при постоянной температуре;
адиабатный — при котором отсутствует теплообмен с окружающей средой;
политропный — удовлетворяющий уравнению pvn = const.
Первые четыре процесса являются частными случаями политропного процесса.
При исследовании этих процессов определяют уравнение процесса в координатах р, v и Т, s, связь между параметрами состояния газа, изменение внутренней энергии, величину внешней работы и количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс. При изохорном процессе выполняется условие dv = 0 или v = const. Из уравнения состояния идеального газа следует, что
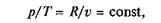
т.е. давление газа прямо пропорционально его абсолютной температуре:
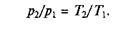
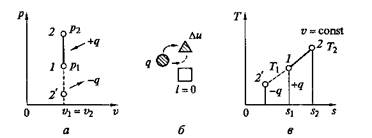
Рис.2.4. Изохорный процесс на p–v- и Т– s-диаграммах (а, в) и схема энергобаланса (б)
Графики процесса на р–v и Т–s-диаграммах, а также схема энергобаланса представлены на рис. 2.4. Работа расширения в этом процессе равна нулю, так как dv = 0. Количество теплоты, подведенной к рабочему телу в процессе 1—2 при cv = const, определяется из соотношения
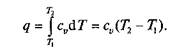
Так как I = 0, то в соответствии с первым законом термодинамики Du = q и Dи = cv (Т2 – Т1)при cv = const.
Изобарный процесс.Изобарным называется процесс, происходящий при постоянном давлении. Из уравнения состояния идеального газа при р = const находим
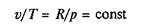
или
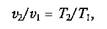
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака). Графики процесса на p–v и Т–s–диаграммах, а также схема энергобаланса изображены на рис. 2.5.
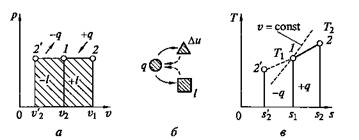
Рис. 2.5. Изобарный процесс на p–v- и Т–s-диаграммах (а, в)
и схема энергобаланса (б)
Из выражения (2.2) следует, что
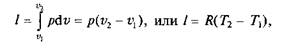
так как 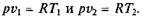
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения
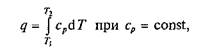
или
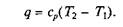
Изотермическим процесс. При изотермическом процессе температура постоянна, следовательно pv = RT = const или р2/р1= v1/v2, т.е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении — падает (закон Бойля –Мариотта).
Графиком изотермического процесса в координатах р,и (рис. 2.6,а)является равнобокая гипербола, для которой координатные оси служат асимптотами.
Работа процесса
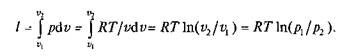
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессе остается постоянной (Du = 0) и вся подводимая к газу теплота полностью превращается в работу расширения: q = I.
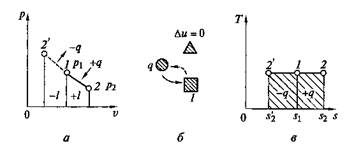
Рис. 2.6. Изотермический процесс на p–v и Т–s диаграммах (а, в)и схема энергобаланса (б)
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе. Схема энергобаланса и график изобарного процесса на Т–s-диаграмме приведены на рис. 2.6, б, в.
Адиабатный процесс. Адиабатным называется процесс изменения состояния газа, который происходит без теплообмена с окружающей средой. Такой процесс соответствует случаю, когда, сосуд или оболочка, вмещающие в себе газ, изолированы в тепловом отношении от окружающей среды. Для данного случая уравнение первого закона термодинамики, поскольку в нем. по условию Dq = 0, принимает вид
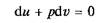
или
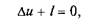
откуда
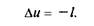
Это означает, что в адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа и что при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через сад и выразим условие dq = 0 следующим образом:
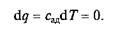
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю, т.е. сад = 0. Известно, что
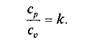
Уравнение кривой адиабатного процесса (адиабаты) в координатах р, v (рис. 2.7,а)имеет вид
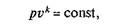
где к называется показателем адиабаты (эту величину называют также коэффициентом Пуассона).
Из выражений 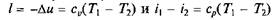 следует, что
следует, что
т.е. техническая работа адиабатного процесса расширения равна разности энтальпий начала и конца процесса.
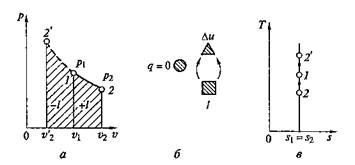
Рис. 2.7. Адиабатный процесс на p–v и T–s-диаграммах (а, б) и схема
энергобаланса (в)
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. На T–s-диаграмме (рис. 2.7,в)он изображается вертикальной прямой.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате которого всегда выделяется теплота, которая тут же сообщается самому рабочему телу. В этом случае ds>0, процесс называется реальным адиабатным процессом.
Политропный процесс и его обобщающее значение.Политропным называется процесс, который описывается уравнением

Показатель политропы п может принимать любое численное значение в пределах от –∞ до +∞, но для данного процесса он является величиной постоянной.
Из уравнения (2.13) и уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между р, v и Т в любых двух точках на политропе:
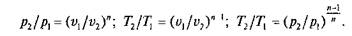
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
2.5. Реальные газы и водяной пар
Реальные газы. К реальным газам в технической термодинамике принято относить перегретые пары некоторых жидкостей. В отличие от воображаемого идеального газа реальный газ при соответствующих условиях может быть сжижен, т.е. сконденсирован, или же переведен в твердое состояние.
В технике широко применяют пары различных веществ: воды, аммиака, хлористого метила, сернистого ангидрида и др. Наибольшее применение имеет водяной пар, являющийся основным рабочим телом паровых двигателей, отопительных и других устройств.
Известно, что законы идеальных газов нельзя распространить на рабочие тела, состояние которых не очень удалено от жидкой фазы.
В связи с этим на водяной пар при давлениях и температурах, обычно применяемых в теплоэнергетике, не распространяется уравнение состояние Клапейрона. Из ряда предлагавшихся уравнений состояния, применимых для него с известной степенью приближенности, можно отметить уравнение Ван-дер-Ваальса, составленное для реальных газов и имеющее вид
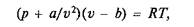
где а и b — постоянные для данного газа.
Слагаемое a/v2 в первом множителе учитывает влияние сил взаимодействия молекул, величина b во втором множителе учитывает влияние объема молекул (поскольку в идеальном газе, для которого и справедливо уравнение состояния Клапейрона, объем молекул полагается равным нулю).
Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно не дает результаты, достаточно точные для нужд современной паротехники. Наиболее точным является в настоящее время уравнение состояния реальных газов, разработанное М.П.Вукаловичем и Н.И.Новиковым (МЭИ) применительно в основном к водяному пару. Вывод этого уравнения основан на предположении наличия в реальных газах ассоциаций молекул, механически объединенных в двойные, тройные и более сложные комплексы, образующиеся в результате взаимодействия между ними. Для этого уравнения характерно близкое совпадение результатов расчетов с опытными данными. Однако для практических целей пользование этим, как и другими уравнениями состояния реального газа, неудобно вследствие сложности их и необходимости выполнения трудоемких вычислений. Обычно пользуются готовыми данными, которые берут из таблиц водяного пара пли из i, s-диаграммы водяного пара.
Промежуточное состояние вещества между состоянием реального газа и жидкостью принято называть парообразным, или просто паром. Превращение жидкости в пар представляет собой фазовый переход из одного агрегатного состояния в другое. При фазовом переходе наблюдается скачкообразное изменение физических свойств вещества.
Примерами таких фазовых переходов являются процесс кипения жидкости с появлением влажною насыщенного пара и с последующим переходом ею в лишенный влаги сухой насыщенный пар или обратный кипению процесс конденсации насыщенного пара. Во всех этих фазовых переходах существует однозначная связь между давлением и температурой (в данном примере — связь давления с температурой кипения или конденсации).
Одно из основных свойств сухого насыщенного пара заключается в том, что дальнейший подвод теплоты к нему приводит к возрастанию температуры пара, т. е. переходу его в состояние перегретого пара, а отвод теплоты — к переходу в состояние влажного насыщенного пара. В современной теплоэнергетике основным рабочим телом является водяной пар. Поэтому изучение термодинамических свойств паров рассмотрим на примере водяного пара.
Водяной пар.На рис. 2.8 изображены фазовые состояния воды и водяного пара в координатах Т, s. Здесь может быть выделено несколько областей:
область I — газообразное состояние (перегретый пар, обладающий свойствами реального газа).
область II —- равновесное состояние воды и насыщенного водяного пара (двухфазное состояние), двухфазную область //называю также областью парообразования;
область III, ограниченная изотермой ЕК, — жидкое состояние (вода).
Области III, II I отделены так называемыми пограничными линиями: левой АК иправой KD. Общая для левой и правой пограничных линий (и областей III, II I)точка K обладает особыми свойствами и называется критической точкой. Эта точка имеет определенные параметры pкр, vкри Tкр, при которых кипящая вода переходит в перегретый пар, минуя двухфазную область. Отсюда следует, что вода (точнее ее жидкая фаза) не может существовать при температурах выше Tкр. Будучи нагретым до этой температуры, весь объем воды практически мгновенно должен превратиться в пар. Вместе с тем пар при давлениях, больших, чем ркр, и при охлаждении до температуры Ткр непосредственно превращается в жидкость, минуя область влажного пара. Критическая точка воды имеет следующие параметры: ркр = 22,136 МПа; tKp = 374,15 °С; vKp - 0,00326 м3/кг.
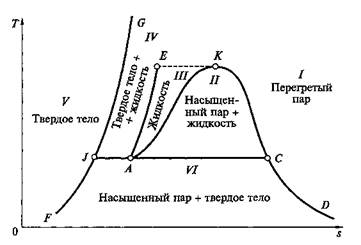
Рис. 2.8. Фазовая диаграмма для воды и водяного пара в координатах Т, s
Значения р, t, v и s для обеих пограничных линий (кипения и сухого насыщенного пара) приводятся в специальных таблицах термодинамических свойств водяного пара.
На современных крупных тепловых электростанциях основным двигателем является паровая турбина, где в качестве рабочего тела используется водяной пар, который получают в паровых котлах. Процесс парообразования в котлах обычно происходит при постоянном давлении, т. е. р = const.
Процессы нагрева воды до кипения, парообразования и перегрева водяного пара на p–v и Т–s-диаграммах изображены на рис. 2.9.
Для обозначения величин, относящихся к различным состояниям воды и пара, устанавливается следующая индексация:
индекс 0 означает, что величина относится к начальному состоянию воды;
индекс ' – к воде, нагретой до температуры кипения;
индекс " – к сухому насыщенному пару;
индекс х – к влажному насыщенному пару;
без индекса — относится к перегретому пару.
Рассматривая процесс парообразования при более высоком давлении р1 > р0можно отметить, что точка а, соответствующая состоянию жидкой воды при температуре 0°С и новом давлении, остается практически на той же вертикали, так как удельный объем воды почти не зависит от давления. Точка b’ соответствующая состоянию воды при температуре кипения, смещается вправо (на р–v-диаграмме) и поднимается вверх (на T–s-диаграмме), так как с увеличением давления увеличивается температура кипения и, следовательно, удельный объем воды. Точка с', соответствующая состоянию сухого насыщенного пара, смещается влево, так как с увеличением давления удельный объем пара уменьшается несмотря на увеличение температуры.
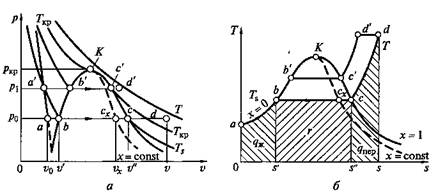
Рис. 2.9. р–v-диаграмма (а)и Т– s-диаграмма (б) для воды и водяного пара
Соединение множества точек b и с при различных давлениях дает нижнюю и верхнюю пограничные кривые аК и Кс. Из p—v-диаграммы видно, что по мере увеличения давления разность удельных объемов v' и v" уменьшается и при некотором давлении становится равной нулю. В этой точке, называемой критической, сходятся пограничные кривые а К и Кс. Состояние, соответствующее точке К, называется критическим. Оно характеризуется тем, что при нем пар и вода имеют одинаковые удельные объемы и не отличаются по свойствам друг от друга.
Заметим, что на Т–s-диаграмме площадь Oabs', соответствует количеству теплоты, требующемуся для нагрева жидкой воды до температуры кипения. Количество подведенной теплоты, равное теплоте парообразования r, Дж/кг, выражается площадью s'bcs" и определяется уравнением
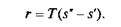
Количеству подведенной теплоты в процессе перегрева водяного пара соответствует площадь s"cds.
На Т–s-диаграмме видно, что по мере увеличения давления теплота парообразования уменьшается и в критической точке становится равной нулю.
Обычно Т–s-диаграмма применяется при теоретических исследованиях, так как практическое использование ее сильно затрудняется тем, что количество теплоты выражается в ней площадями криволинейных фигур.
I–s-диаграмма водяного пара.Рассмотренная Т–s-диаграмма (см. рис. 2.9,б)дает возможность наглядно представить характер протекания процесса превращения воды в пар различных состояний (влажный, сухой насыщенный и перегретый). Однако при пользовании этой диаграммой устанавливать количества участвующей в процессе теплоты сложно, так как это связано с необходимостью определять по диаграмме соответствующие площади, частично ограниченные кривыми линиями. Поэтому для практических расчетов обычно пользуются i—s-диаграммой водяного пара, по которой это выполнить можно значительно проще. Эта диаграмма (рис. 2.10) представляет собой график, построенный в системе координат i, s, на который нанесены: изобары, изохоры, изотермы, пограничные кривые и линии постоянной степени сухости пара.
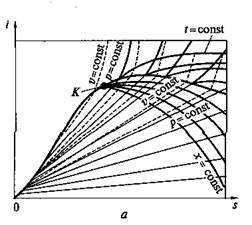
Рис. 2.10. i—s-диаграмма для воды и водяного пара (а)и се практически используемая область для водяного пара (б)
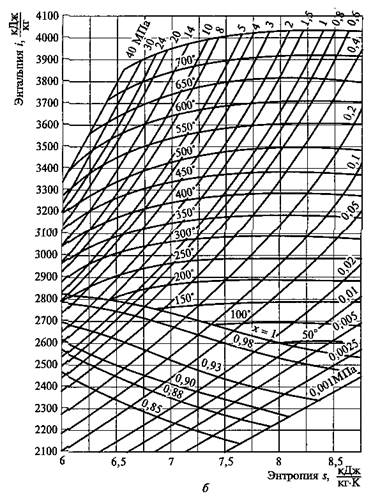
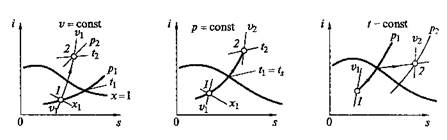
Рис. 2.11. Основные термодинамические процессы водяного пара в координатах i, s
На рис, 2.11 представлены основные термодинамические процессы для водяного пара в координатах i, s.
Достоинством i–s-диаграммы является то, что техническая работа и количество теплоты изображаются на ней отрезками, а не площадями, поэтому она нашла широкое применение в технике,
2.6. Круговой процесс, цикл Карно
Круговой процесс. Ранее было показано, что величины работы и количества теплоты в каком-либо произвольном политропном термодинамическом процессе зависят от характера процесса (показателя политропы); знак работы (положительный или отрицательный) зависит от направления процесса (расширения или сжатия).
Если, например, между точками 1 и 2 (рис. 2.12,а)рабочее тело осуществляет последовательно ряд процессов расширения на пути 1—а—2, а затем также последовательно — ряд процессов сжатия на пути 2—b—1, то в итоге оно совершает так называемый круговой процесс (1–а–2–b–1), или термодинамический цикл, описывающий изменение термодинамических параметров рабочего тела и преобразование теплоты в работу в тепловых машинах.
Непрерывность действия тепловой машины обеспечивается тем, что рабочее тело с параметрами р1, v1, Т1пройдя последовательно ряд процессов расширения на пути 1–а–2 и затем ряд процессов сжатия 2–b–1 с изменением р, v, Т, вновь возвращается в точку 1 (исходное состояние), где p = р1, v = v1, T = Т1и цикл может быть повторен.
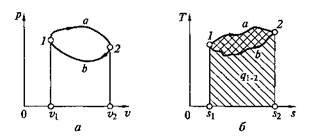
Рис. 2.12. Круговой процесс (цикл): а – на p–v-диаграмме, б – на Т–s-диаграмме
На p–v-диаграмме площадь v1–1–а–2–v2соответствует величине работы расширения:
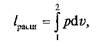
аплощадь контура v2–2–b–1–v1— величине работы сжатия:
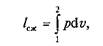
причем lрасш > lсж.
Так как работа является функцией процесса, а не состояния, то в итоге совершения замкнутого кругового процесса (цикла) в машине непрерывного действия, где lрасш > lсж, рабочее тело имеет возможность совершить работу lц = lрасш –lсжэ которой на рис. 2.12, а соответствует площадь внутри контура цикла 1–а–2–b–1.
Так как при процессах расширения к рабочему телу подводилась теплота qрасш, то, согласно первому закону термодинамики,
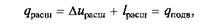
причем на Т–s-диаграмме (рис. 2.12, б)подведенная теплота qnom определяется площадью контура s1–1–a–2–s2, а отведенная теплота qотвпри сжатии – площадью контура s2–2–b–l–s1. При этом qсж = Dисж + lсж = qотв, причем qрасш > qсж или qпод > qотв.
Так как внутренняя энергия является функцией состояния, т. е. величиной, не зависящей от пути процесса, то для любого кругового процесса (цикла)
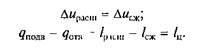
Отсюда следует, что полезная работа цикла Iц должна быть равна разности теплоты, подведенной и отведенной при совершении цикла.
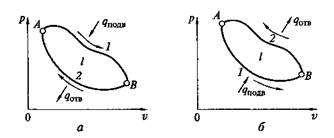
Рис. 2.13. Прямой (а)и обратный (б)циклы на p–v-диаграмме
В цикле, показанном на рис. 2.13,а, линия процесса расширения располагается выше линии процесса сжатия, вследствие чего lрасш > lсж и lц = lрасш – lсж. Такие циклы называют прямыми. Очевидно, можно осуществить и другие циклы, в которых процессы сжатия располагаются в р–v-диаграмме выше, чем процессы расширения (рис. 2.13,б). Такие циклы обычно называют обратными, причем для таких циклов lрасш < lсж и qnom < qотв, откуда lрасш – lсж =:–lц.
Так как
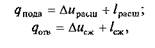
то
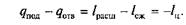
Последние соотношения показывают, что для совершения обратного цикла к рабочему телу должна быть подведена извне работа –lц, которая в результате совершения цикла превращается в теплоту.
Таким образом, результатом обратного цикла является перенос теплоты от холодного источника к более горячему, что в технике используется для создания холодильных установок.
Термический КПД цикла.Прямые термодинамические циклы, в которых за счет теплоты источника может быть получена полезная работа, отдаваемая внешним потребителям, носят название циклов теплоэнергетических установок. Обратные термодинамические циклы могут применяться либо для отвода теплоты в окружающую среду от рабочего тела, имеющего более низкую температуру (холодильные установки), либо для передачи теплоты от тел с более низкой температурой для нагревания окружающей среды (тепловые насосы).
Задачей прямого цикла является получение работы за счет теплоты источника:
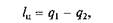
где q1— теплота от горячего источника; q2— теплота, отданная холодному источнику.
Оценка совершенства такого никла, составленного из обратимых процессов, производится с помощью так называемого термического (или термодинамического) коэффициента полезного действия ht путем сопоставления полученной работы lц и подведенной теплоты q1:
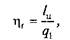
или
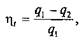
или

Из этих соотношений следует, что термический КПД прямого обратимого цикла определяет, какая часть подведенной в цикле теплоты q1превращается в работу lц.
Для обратного цикла холодильных установок критерием эффективности служит холодильный коэффициент

где q2 — теплота, отведенная от холодного источника.
Так как затраченная для осуществления цикла работа lц = q1– q2, то
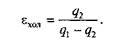
В холодильной установке рабочими телами служат, как правило, пары легкокипящих жидкостей — фреона, аммиака и т. п. Процесс «перекачки теплоты» от тел, помещенных в холодильную камеру, к окружающей среде происходит за счет затрат электроэнергии.
Заметим, что чем меньше разность температур между холодильной камерой и окружающей средой, тем меньше нужно затратить энергии для передачи теплоты от холодного тела к горячему и тем выше холодильный коэффициент.
Холодильную установку можно использовать в качестве теплового насоса. Если, например, для отопления помещения использовать электронагревательные приборы, то количество теплоты, выделенное в них, будет равно расходу электроэнергии. Если же это количество электроэнергии использовать для работы теплового насоса, когда горячим источником, т.е. приемником теплоты qu является отапливаемое помещение, а холодным — наружная атмосфера, то количество теплоты, полученное помещением,
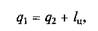
где q2— количество теплоты, взятое от наружной атмосферы; lц — расход электроэнергии.
Понятно, что q1 > lц, т.е. отопление с помощью теплового насоса выгоднее простого электрообогрева.
На рис. 2.14 показана термодинамическая схема холодильной машины (теплового насоса).
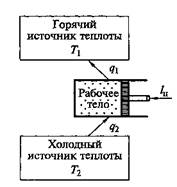
Рис. 2.14. Термодинамическая схема холодильной машины
Цикл Карно.Среди обратимых циклов особое значение имеет цикл, исследованный в 1824 г. французским ученым С. Карно и носящий его имя. Цикл Карно состоит в преобразовании теплоты в работу при наличии только двух источников теплоты: верхнего с температурой Т1 и нижнего с температурой Т2 < Т1(рис. 2.15). В прямом цикле Карно рабочее тело от точки 1 расширяется сначала при Т1= const с подводом теплоты qx на участке 1—а, затем в адиабатном процессе до точки 2, охлаждаясь до температуры Т2 = const, после этого сжимается при Т2= const с отводом теплоты q2 на участке 2-й, а потом по адиабате до восстановления первоначальных параметров в точке 1.
Поскольку в обратимом процессе работа трения отсутствует, то изменения энтропии в адиабатных процессах а–2 (расширение) и b–1 (сжатие) не происходит, следовательно,
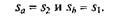
В соответствии с этим подведенная в изотермическом процессе при Т1= const теплота
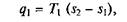
а отведенная теплота
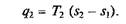
Термический КПД цикла Карно в соответствии с формулой (2.14):
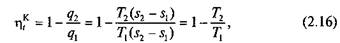
или
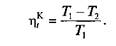
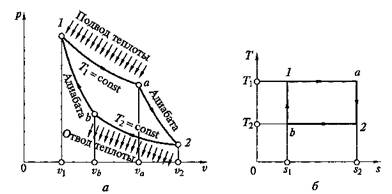
Рис. 2.15. Прямой цикл Карно:
а — на р–v-диаграмме; б — на T–s-диаграмме
Таким образом, в отличие от КПД всех других циклов термический КПД цикла Карно полностью определяется только температурами верхнего и нижнего источников теплоты и возрастает с повышением Т1 и снижением Т2. При этом КПД цикла Карно не зависит от рода теплоносителя и от величины полученной за цикл полезной работы.
Цикл Карно обладает также весьма важным свойством, которое позволяет использовать его как эталонный цикл: он имеет наивысший (для данных температур источника и холодильника) термический КПД. Таким образом, можно утверждать, что при данной разности температур Т1 и Т2 термический КПД любого обратимого цикла не может быть больше термического КПД обратимого цикла Карно, осуществляемого при тех же температурах Т1 и Т2.
Это же утверждение может быть сделано и по отношению к любому обратному обратимому циклу, для температурных условий которого цикл Карно будет иметь наибольшие возможные значения холодильного коэффициента эффективности. При обратных циклах следует иметь в виду, что наиболее эффективным из них будет тот, который для переноса теплоты q2 с температурного уровня Т2на Т1потребует подвода извне наименьшей работы, тогда как при прямом цикле эффективность определяется получением максимальной работы lнмах за счет подвода теплоты q1.
Контрольные вопросы
1.Укажите основные параметры состояния рабочего тела и единицы измерения их.
2.Чем отличается реальный газ от идеального газа?
3.Дайте определение средней и истинной теплоемкости. Чем отличается теплоемкость ср от cv?
4.Объясните сущность первого закона термодинамики и напишите его математическое выражение.
5.Опишите основные термодинамические процессы и укажите энергобаланс этих процессов.
6.Какова сущность второго закона термодинамики? Дайте некоторые формулировки этого закона.
7 что такое цикл Карно? Чем оценивается его эффективность?
8.Покажите на p—v- и Т–s-диаграммах характерные области и линии для воды и водяного пара.
9.Покажите на Т–s-диаграмме площадки, соответствующие теплоте, затрачиваемой на подогрев воды, парообразование и на перегрев пара
10.Чем определяется эффективность холодильной установки?
Дата добавления: 2015-10-13; просмотров: 2658;
