Химические свойства карбоновых кислот
Химические свойства карбоновых кислот обусловлены наличием в молекуле карбоксильной группы, которая характеризуется высокой полярностью за счет смещения электронной плотности от атома водорода по направлению к карбоксильному атому кислорода.
δ-
 О
О
δ+ //
R─C
\ δ- δ+
О←Н
1. Кислотно-основные свойства. Смещение электронной плотности от атома водорода, значительно ослабляет связь – О – Н. вследствие этого карбоксильная группа способна отщеплять протон. В водных растворах карбоновые кислоты диссоциируют, образуя карбоксилат-ион (анион соответствующей кислоты) и протон.
 R – СООН R – СОО - + Н+
R – СООН R – СОО - + Н+
Сами кислоты проявляют достаточно сильные кислотные свойства. pKa кислот около 4,7-4,8 (данное значение соответствует величине рН, при котором соединение ионизировано на 50%). Длина радикала практически не влияет на силу кислотных свойств. Введение в углеводородный радикал электроноакцепторных заместителей, обладающих отрицательным индуктивным эффектом (-I), таких как: галогены,Ю гидроксильная группа, нитрогруппа, дополнительная гидроксильная группа, приводит к значительному повышению (на 1-3 единицы рКа) кислотности карбоксильной группы
Н
│
CI←C←C←О←Н
│ ║
Н О
Алкильные группы, обладающие положительным индуктивным эффектом (+I), наоборот, ослабляют кислотные свойств карбоксильной группы.
Н
│
Н3С→С→СООН
│
Н
2. Реакции солеобразования. Карбоновые кислоты взаимодействуют с реакционно-способными металлами (К, Nа), основаниями, карбонатами и гидрокарбонатами щелочных металлов (калия и натрия), образуя соответствующие соли.
ОО
// //
 R─C + Nа2СО3 2 R─С + СО2 + Н2O
R─C + Nа2СО3 2 R─С + СО2 + Н2O
\ \
О─Н ОNа
Калиевые и натриевые соли карбоновых кислот, как правило, бесцветны и водорастворимы. Кислоты в анионной форме (в виде солей) реагируют с солями тяжелых металлов (меди (II), железа (III), кобальта(II)) c образованием труднорастворимых осадков. Соли меди окрашены в сине-зеленый, железа- в желто-розовый, кобальта – в розовый цвет.
Данные реакции можно использовать для доказательства подлинности карбоновых кислот.
3. Реакция этерификации.При нагревании смеси карбоновых кислот с этанолом в присутствии концентрированной серной кислоты, как водоотнимающего средства, происходит образование сложного эфира.
H2SO4 k
 R – COOH + HO - R´ R – C – O - R´
R – COOH + HO - R´ R – C – O - R´
- H2O ║
O
Сложные эфиры, как правило, обладают характерным фруктовым запахом.
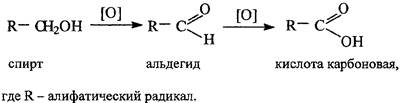
Получение
Карбоновые кислоты 1. Из галогенпроизводных. 2. Окислением спиртов
Соли карбоновых кислот – нейтрализацией соответствующих кислот карбонатом калия, натрия или кальция. Все соли затем очищают перекристаллизацией.
Кислоту вальпроевую получают синтетически.
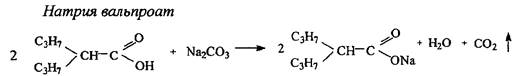
2-пропилвалериановая кислота
Дата добавления: 2015-09-07; просмотров: 1548;
