ОБМІН ЛІПІДІВ В ОРГАНІЗМІ.
РОЗЩЕПЛЕННЯ ЛІПІДІВ У ТРАВНОМУ ТРАКТІ ЛЮДИНИ. Тріацил-гліцериди, тобто жири, надходять в організм з їжею тваринного і рослинного походження. У великій кількості вони містяться в салі, рослинній олії і вершковому маслі, м'ясі, курячих яйцях, печінці.
Розщеплення ліпідів у травному тракті людини має кілька стадій. Для цього процесу необхідні ліполітичні ферменти (і відповідні умови для їхньої діяльності) і емульгатори (детергенти). За сучасною класифікацією ліполітичні ферменти відносяться до групи гідролаз, які каталізують розщеплення різних ліпідів. У травному тракті людини субстратами гідролітичного розщеплення є триацилгліцероли, фосфоліпіди, ефіри холестеролу.
Оптимальна умова для дії ліполітичних ферментів – рН 7,8…8,2. Гідролітичному розщепленню в шлунку піддаються тільки емульговані жири. Такі ліпіди містяться в молоці і молочних продуктах, яєчному жовтку, майонезах. Всі інші жири їжі мають потребу в емульгаторах, що знижують поверхневий натяг і перешкоджають склеюванню жирових крапель.
Емульгатори мають гідрофільні і гідрофобні групи, вони оточують кожну краплю жиру таким чином, що гідрофільні групи звертаються до води, а гідрофобні – до жиру. Основними емульгаторами жирів у травному тракті людини є солі жовчних кислот.
У порожнині рота переварювання ліпідів не відбувається через відсутність ліпаз. У шлунку йде незначний гідроліз емульгованих жирів під дією малоактивної ліпази шлункового соку. Основна кількість харчових жирів гідролізується в тонкому кишечнику під дією ліпази, що утворюється в підшлунковій залозі.
Емульгування жирів відбувається в порожнині кишечнику під впливом дрібних пухирців вуглекислого газу, що рясно виділяються при нейтралізації хлоридної кислоти харчової кашки бікарбонатами підшлункового і кишкового соків. У процесі перистальтики кишечнику жири роздрібнюються на дуже дрібні краплі, що емульгуються при участі парних жовчних кислот і моноацилгліцеролів. Основну роль при цьому грають солі жовчних кислот (мила), що виділяються з жовчю в просвіт кишечнику. Вони адсорбуються на поверхні крапель жиру, утворюють на них найтоншу плівку, що перешкоджає злиттю крапельок у більш великі краплі. Разом з тим жовчні кислоти різко зменшують натяг на поверхні двох фаз – води і жиру, що сприяє дробленню його крапель на більш дрібні. При цьому утвориться тонка емульсія (діаметр часток не перевищує 0,5 мкм), що полегшує ферментативний гідроліз жиру. Одночасно жовчні кислоти активують ліпазу.
Жовчні кислоти являють собою похідні холанової кислоти, що синтезується з холестеролу. У жовчі людини містяться в основному похідні холанової кислоти: холева, дезоксихолева, глікохолева, хенодезоксихолева, таурохолєва і літохолева кислоти, причому головним чином їх натрієві солі, що складаються з холевої і дезоксихолевої кислот, глікоколу і таурину.

Велика частина емульгованого жиру піддається гідролітичному розщепленню під дією ліпаз з утворенням гліцеролу і вищих жирних кислот.
Ліпази бувають двох типів: одна розщеплює ефірні зв'язки триацилгліцеролів у положеннях 1 і 3, інша – у положенні 2. У розщепленні моноацилгліцеролів бере участь також ліпаза, що міститься в кишковому соку.
Гідроліз є першою фазою обміну жирів. Він протікає східчасто, причому спочатку розщеплюються зовнішні складноефірні зв'язки. a-моноацилгліцероли, що утворилися, всмоктуються стінкою кишечнику. Потім вони або йдуть на ресинтез триацилгліцеролів у кишковій стінці, або розпадаються під дією неспецифічних естераз. Жирні кислоти, що виділилися з розщеплених гліцеролів, погано розчиняються у воді і всмоктуються ворсинками кишечнику лише після взаємодії з жовчними кислотами з утворенням парних розчинних комплексів. В епітеліальних клітинах ворсинок кишечнику відбувається їхнє розщеплення на жовчні і жирні кислоти. Жовчні кислоти знову безпосередньо надходять у просвіт кишечнику або проходять більш складний шлях: кров-печінка-жовчний міхур-жовч.
Постійна циркуляція жовчних кислот забезпечує велику кількість всмоктуваних жирів при порівняно обмеженому виробленні печінкою жовчних кислот (2,8…3,5 г у добу).
Переварювання ліпідів відбувається як у порожнині кишок (порожнинне травлення), так і на слизовій оболонці тонкої кишки (пристінкове або контактне травлення). Зокрема, на поверхні клітин адсорбується ліпаза соку підшлункової залози (панкреатична), яка каталізує гідроліз жирів.
З епітеліальних клітин стінки кишечнику жири у виді дрібних жирових крапель, оточених білками (хіломікрони), попадають у лімфу.
Хіломікрони відносяться до складних ліпідів. За будовою це сферичні частки (100…5000 нм), зовнішня оболонка яких утворена білками, а внутрішня – ліпідами і їхніми похідними. Хіломікрони – найбільш великі з ліпопротеїдів. До їхнього складу входить 98…99 % ліпідів і 1…2 % білка. Утворюючись в клітинах слизової оболонки кишечнику, вони забезпечують транспорт ліпідів (триацилгліцеролів) з кишечника в лімфу.
Хіломікрони через грудну лімфатичну протоку надходять у кровоток і транспортуються в "жирові депо" і печінку.
Таким чином, за допомогою хіломікронів здійснюється транспорт із кишечнику в кров екзогенних триацилгліцеролів, холестеролу і частково фосфоліпідів. Через 1…2 год. після прийому їжі спостерігається аліментарна гіперліпемія, максимальної величини вона досягає через 4…6 годин після прийому жирної їжі. Через 10…12 годин вміст триацилгліцеролів повертається до норми, а хіломікрони зникають із кров'яного русла, тому що розпадаються на більш дрібні частки під впливом ліпопротеїнліпази (фактор просвітління) внутрішньої оболонки стінок судин.
Ліпопротеїнліпаза не тільки розщеплює хіломікрони, але і гідролізує триацилгліцероли, що виділилися при цьому, на гліцерол і жирні кислоти, що можуть безпосередньо надходити в клітки і піддаватися процесам розпаду. Частина жирних кислот попадає в кров, де адсорбується альбуміном сироватки, потім переноситься до органів і включається в процеси обміну (рис. 8).
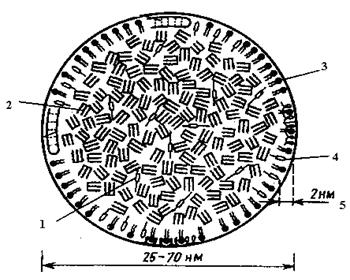
Рис 8. Модель ліпопротеїдів.
1 – ефіри холестерола; 2 – триацилгліцероли; 3 – фосфоліпіди; 4 – холестерол; 5 – полярний шар.
Частина жирів безпосередньо всмоктується в кров, минаючи лімфатичну систему, і надходить у печінку. Через деякий час з печінки жири переходять у периферичне депо: підшкірну клітковину, сальник, брижі. Жири з «жирових депо» осідають в інших тканинах, головним чином, у печінці, де піддаються окисному розщепленню до кінцевих продуктів обміну речовин. Транспорт жирів у крові забезпечують білки плазми: b- і g-глобуліни, альбуміни.
Холестерол попадає в шлунково-кишковий тракт людини переважно з яєчним жовтком, м'ясом, печінкою, мізками. З їжею людина одержує щодня 0,1…0,3 г холестеролу у вільному виді або у виді його ефірів. Останні при участі ферменту панкреатичного соку – холестеролестерази розщеплюються на холестерол, що може всмоктуватися у виді комплексу з жовчними кислотами, і жирні кислоти.
Фосфоліпіди, зокрема лецитини, під впливом відповідних гідролаз, розщеплюються на гліцерол, вищі жирні кислоти, холін і фосфорну кислоту. Компоненти фосфоліпідів усмоктуються кишковою стінкою і надходять у кров (фосфорна кислота, в основному, у виді натрієвих і калієвих солей).
З продуктів гідролізу харчових ліпідів у клітинах кишкового епітелію ресинтезуються ліпіди, специфічні для певного виду тварин.
Важлива роль в обміні жирів належить печінці. Її ферментативні системи каталізують переважну більшість реакцій метаболізму ліпідів. У печінці синтезуються триацилгліцероли, що або затримуються в ній, або у виді ліпопротеїнів надходять у кров.
Розрізняють два види ліпопротеїнів, що утворюються в печінці: пре-b-ліпопротеїни (ліпопротеїни дуже низької щільності – ЛПОНП) і a-ліпопротеїни (ліпопротеїни високої щільності – ЛПВП). У плазмі крові людини з пре-b-ліпопротеїнів утворюються b-ліпопротеїни (ліпопротеїни низкої щільності - ЛПНП).
З усіх ліпопротеїнів плазми крові атерогеністю володіють b-ліпопротеїни низької і дуже низької щільності. Вони здатні проникати всередину судинної стінки з плазми крові, будучи первинним субстратом, що викликає атероскле-ротичну поразку артерій. При атеросклерозі рівень холестеролу в крові підвищується в 2…5 разів (іноді до 13 ммоль/л). Причиною гіперхолестеролемії є порушення рівноваги між кількістю холестеролу, що розпадається, і синтезованого холестеролу. Основну роль у виникненні гіперхолестеролемії належить ендогенному холестеролу. Збільшення цього показника відзначено при надлишковому споживанні жирів і вуглеводів і порушенні їх утилізації.
Холестерол з ацетил-КоА також синтезується в печінці. Активність цього процесу залежить від кількості екзогенного холестеролу, що надходить з їжею. Біосинтез холестеролу в печінці регулюється за принципом негативного зворотного зв'язку: чим більше його надходить з їжею, тим менше синтезується в печінці, і навпаки.
Частина синтезованого холестеролу перетворюється в жовчні кислоти і виділяється з організму з жовчю, крім того він використовується для синтезу стероїдних гормонів і інших сполук. У печінці відбувається його взаємодія з жирними кислотами з утворенням ефірів, що надходять у кров.
У печінці відбувається розпад і синтез фосфоліпідів. Для їхнього синтезу, крім гліцеролу і вищих жирних кислот, необхідні неорганічні фосфати і азотисті основи, зокрема холін. Неорганічні фосфати в печінці містяться в достатній кількості, а холіну мало, тому він обов'язково повинний надходити з їжею.
При дефіциті холіну синтез фосфоліпідів з нейтрального жиру різко знижується або зовсім припиняється, і нейтральний жир відкладається в печінці, тобто відбувається жирова інфільтрація цього органа, що грозить перейти в її жирову дистрофію. Запобігають цьому ліпотропні речовини (холін, метіонін і інші джерела метильних груп), що містяться в сирі й інших молочних продуктах, м'ясі та ін.
ОБМІН ЛІПІДІВ У ТКАНИНАХ. Обмін ліпідів у тканинах є біологічно найбільш важливим етапом їхнього перетворення. На цій фазі відбувається асиміляція ліпідів у виді пластичного матеріалу і розщеплення їх з вивільненням енергії.
Головним ендогенним джерелом ліпідів, що грають роль метаболічного палива, служить резервний жир, що міститься в протоплазмі клітин у виді крапельок. Для цієї мети використовуються також фосфоліпіди мембран.
У «жирових депо» при участі тканинних ліпаз відбувається гідроліз простих жирів на глицерол і вільні жирні кислоти. Гліцерол фосфорилюється за рахунок АТФ, через ряд проміжних реакцій перетворюється у фосфогліцеро-ловий альдегід, що потім окиснюється в процесі гліколізу до фосфогліцеролової і піровиноградної кислот. Остання, піддаючись окисному декарбоксилюванню, перетворюється в ацетил-КоА, що у циклі трикарбонових кислот окиснюється до СО2 і Н2О.
У виді комплексу з альбумінами вільні жирні кислоти зі струмом крові попадають в органи і тканини, де комплекс розпадається, а жирні кислоти або піддаються b-окинюванню, або використовуються в синтезі триацилгліцеролів, холестеролу, гліцерофосфоліпідів, сфінголіпідів і т.д.
b-окиснення вищих жирних кислот. Теорія окиснення вищих жирних кислот була висунута А. Кноопом у 1904 р. Він висловив припущення, що окиснювання молекул жирної кислоти в тканинах організму відбувається в b-положенні шляхом послідовного відщіплення від молекули жирної кислоти з боку карбоксильної групи двох карбогенових фрагментів. У зв'язку з цим процес окиснення жирних кислот називають b-окисненням.
Оскільки будь-яка жирна кислота, що входить до складу природних жирів, має парне число вуглецевих атомів, то відщіплення в кожній реакції по парі карбогенів обов'язково приводить процес до утворення масляної кислоти. Після чергового циклу b-окиснення вона перетворюється в ацетооцтову кислоту, що гідролізується до двох молекул оцтової кислоти. Ця теорія не втратила свого значення дотепер і є основою сучасних уявлень про механізм окиснювання вищих жирних кислот.
b-окиснення вищих жирних кислот відбувається в мітохондріях клітин при участі мультиферментного комплексу.
Початковим етапом b-окиснення є активація молекул вищих жирних кислот при участі АТФ і HSKoА. При цьому утворюються активовані форми: КоА-ефіри цих кислот.
Утворюється активна форма (ацетил-КоА) з жирної кислоти і коензиму А за рахунок енергії АТФ за участю ферменту ацетил-КоА-синтетази. Перенос ацильних груп з цитоплазми на матрикс мітохондрії здійснює карнітин. При участі ферменту карнітин-ацил-трансферази синтезується ацилкарнітин, здатний проникати усередину мітохондрій. Після чого карнітин повертається в цитоплазму клітки, а ацетил-КоА піддається окисненню.
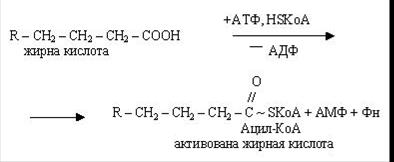
Наступний етап - дегідрування жирних кислот за участю ФАД, при цьому відщепляються два атоми гідрогену в a- і b-положеннях і ацил-КоА перетворюється в КоА-ефир ненасиченої кислоти (еноїл-КоА).
На стадії гідратації еноїл-КоА, взаємодіючи з молекулою води, перетворюється в b-оксикислоту (b-гідрооксиацил).
Друга стадія дегідрування протікає при участі НАД – залежної дегідрогенази з утворенням b-кетокислоти (b-кетоацил-КоА).
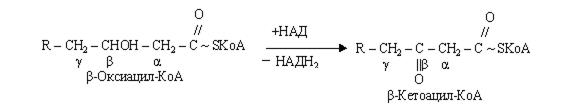
Потім відбувається тіолазна реакція: взаємодія кетоацил-КоА з ацетил-КоА.

У результаті цієї реакції внаслідок розщеплення b-кетоацилу виділяється укорочена на два карбогенових атоми активована вища жирна кислота і двовуглецевий фрагмент у виді ацетил-КоА. Ацетил-КоА, що утворився, окиснюється в циклі трикарбонових кислот, а активована вища жирна кислота багаторазово проходить весь шлях b-окиснення аж до утворення чотирьохвуглецевої сполуки – бутирил-КоА, що у свою чергу окиснюється до двох молекул ацетил-КоА.
Енергетичний ефект b-окиснення. Число циклів окиснення, яким піддається вища жирна кислота, залежить від кількості карбогенових атомів у її молекулі. При окисненні однієї молекули жирної кислоти утвориться n/2 молекул ацетил-КоА, де n – кількість атомів Карбогену, а цикл повториться (n/2 -1) раз, тому що молекула бутирил-КоА відразу розщеплюється на дві молекули ацетил-КоА. У кожнім циклі з'являються молекула ФАДН2 і молекула НАДН2. Молекула ФАДН2 при окиснюванні в дихальному ланцюзі і сполученого з ним фосфорилювання дає дві молекули АТФ, а НАДН2 – три молекули АТФ, тобто за один цикл b-окиснювання утворюється п'ять молекул АТФ.
Кожна молекула ацетил-КоА включається в цикл трикарбонових кислот, поступово розщеплюється до СО2 і Н2О з виділенням 12 молекул АТФ. Як приклад розглянемо b-окиснення пальмітинової кислоти.
При окисненні пальмітинової кислоти відбувається сім циклів b-окиснювання – (16/2…1), що веде до утворення 35 молекул АТФ. У результаті b-окиснення цієї кислоти утворюється вісім молекул ацетил-КоА (16/2), кожна з яких, окиснюючись в циклі трикарбонових кислот, дає 12 молекул АТФ, тобто утворює 96 молекул АТФ. Таким чином, сумарний вихід енергії при окисненні однієї молекули пальмітинової кислоти складе: 35 + 96 = 131 молекула АТФ. Оскільки одна молекула АТФ була витрачена на активізацію вищої жирної кислоти на початку процесу, вихід енергії складе 130 молекул АТФ. Близько 45 % усієї потенційної енергії пальмітинової кислоти при її окисненні в організмі може бути використана для ресинтезу АТФ, інша утилізується у виді теплоти.
Окиснення ненасичених жирних кислот відбувається так само, як і насичених, але має свої особливості, обумовлені положенням подвійних зв'язків. До початку b-окиснення в молекулі жирної кислоти відбувається переміщення подвійного зв'язку з положення 3-4 у 2-3 і зміна конфігурації подвійного зв'язку з цис- у транс- положення.
Більшість природних ліпідів містить жирні кислоти з парним числом вуглецевих атомів. Однак у ліпідах рослин і деяких морських організмів виявляються жирні кислоти з непарним числом вуглецевих атомів. Вони також піддаються b-окисненню, у результаті якого з'являються ацетил-КоА і пропіо-ніл-КоА. Останній перетворюється в сукциніл-КоА – метаболіт циклу Кребса.
Процес b-окиснення вищих жирних кислот за участю НS коензиму А активніше протікає в печінці, жировій тканині, серцевому і кістяковому м'язах, слабкіше – у нирках, підшлунковій залозі та інших органах.
РЕГУЛЯЦІЯ ОБМІНУ ЛІПІДІВ І ЙОГО ПОРУШЕННЯ. Обмін ліпідів в організмі залежить від впливу ряду факторів внутрішнього і зовнішнього середовища. Істотну роль грають також вік, стать, характер харчування, вид трудової діяльності, режим дня, форми відпочинку, кліматогеографічні умови проживання і т.д. Активує процеси синтезу ліпідів і призводить до надлишкового їх накопичення в «жирових депо», а надалі до порушення обміну і виникненню захворювань, такий фактор, як нерегулярне харчування, особливо якщо велика калорійність раціону приходиться на другу половину дня і вечірні години. Несприятливо впливає на обмін жирів різка перевага в раціоні засвоюваних вуглеводів, моносахаридів, що утворюються з них, при малорухомому способі життя повною мірою не використовуються, а перетворюються в жири.
Ліпідний обмін в організмі регулюється центральною нервовою системою. Кора головного мозку впливає на жирову тканину через симпатичну і парасимпатичну нервову систему і ендокринні залози. Кількість жиру в «жирових депо» зменшується при тривалому негативному емоційному стресі, що супроводжується збільшенням викиду гормону надниркових залоз адреналіну в кровоносне русло, що призводить до зменшення маси тіла. Цей ефект пояснюється тим, що жирова тканина рясно інервована волокнами симпатичної нервової системи, а норадреналін, що виділяється, як і адреналін, збільшує швидкість ліполізу в жировій тканині. Крім того, адреналін через систему відповідних ферментів сприяє утворенню активної форми ліпази. Дія глюкагону і тироксину подібно впливу адреналіну і норадреналіну (катехоламінів): вони стимулюють ліполіз.
На ліпідний обмін впливає гормон росту (СТГ), що утворюється в передній частці гіпофіза. При недоліку цього гормону збільшується відкладен-ня жиру в організмі, розвивається гіпофізарне ожиріння. При підвищеній продукції його збільшується ліполіз і вміст жирних кислот у плазмі крові.
Інсулін має дію, протилежну адреналінові і глюкагону: він зменшує утворення активної ліпази в клітинах, підсилює процеси ліпогенезу, сприяє перетворенню вуглеводів у жири, пригнічує окиснювання вищих жирних кислот у тканинах (табл. 3).
Таблиця 3 – Вплив деяких факторів на мобілізацію жирних кислот із жирової тканини
| Фактор | Характер впливу | Передбачуваний механізм дії |
| Катехоламіни, глюкагон, тироксин, глюкокортикоїди | Посилення | Активація аденілатциклази |
| СТГ, АКТГ (гормони гіпофізу) | » | Посилення синтезу аденілатцик-лази і гормоночутливої ліпази |
| Стрес, фізичне навантаження, голодування, охолодження | » | Стимуляція секреції катехоламі-нів и пригнічення секреції інсуліну |
| Простагландини | Пригнічення | Ослаблена дія катехоламінів на аденілатциклазу, пригнічення аденілатциклази |
| Інсулін | » | Гальмування вивільнення жир-них кислот в результаті активації гліколізу в жировій тканині; активація фосфодиестерази Ц-АМФ |
Статеві гормони також виражено діють на жировий обмін: при їхньому недоліку збільшується синтез і відбувається гальмування розпаду жирів, що є однією з причин збільшення маси тіла людей похилого віку, у яких відзначається вікове зниження функції статевих залоз.
Важливе значення в регуляції обміну ліпідів має співвідношення синтезу триацилгліцеролів і фосфоліпідів у тканинах, особливо в печінці. Це поясню-ється тим, що жирні кислоти необхідні як для синтезу триацилгліцеролів, так і фосфоліпідів. Триацилгліцероли здатні відкладатися в резерв і при надлишковому накопиченні можуть викликати порушення діяльності кліток, аж до їхньої загибелі. Фосфоліпіди є гідрофільними сполуками: вони виводяться з печінки і доставляються до інших органів і тканин, що стимулює їх синтез і відповідно знижує утворення триацилгліцеролів.
У нормі вміст загальних ліпідів у крові складає 400…800 мг/л. Він змінюється в залежності від статі, віку, характеру і режиму харчування, рівня фізичної активності.
Порушення ліпідного обміну можуть наставати вже в процесі переварювання й усмоктування жирів унаслідок захворювань травного тракту. Крім того, вони можуть бути зв'язані з недостатнім надходженням у кишечник ліпази соку підшлункової залози або жовчі.
При спадкоємному захворюванні, обумовленому недостатньою активністю ліпопротеїнліпази крові, порушується перехід жирних кислот з хіломікронів плазми в «жирові депо». У плазмі збільшується вміст хіломікро-нів, внаслідок чого вона здобуває молочний колір. Підвищення рівня ліпідів у крові (гіперліпемія) може бути викликано фізіологічними причинами, наприклад, прийомом їжі (аліментарна гіперліпемія). Гіперліпемії виникають нерідко при цукровому діабеті, захворюваннях підшлункової залози (панкреа-тити), печінки (гепатити), нирок (нефрози). У їхній основі лежать порушення енергетичного обміну, зв'язані з недостатнім використанням вуглеводів і посиленим окиснюванням жирів. При цьому активізуються процеси мобілізації жиру (триацилгліцеролів) з «жирових депо». Він надходить у кров (транспортна гіперліпемія) і доставляється до тих органів, що мають недолік в енергії.
Гіперліпемії спостерігаються при деяких отруєннях, порушенні функції щитовидної, статевих і надниркових залоз.
У ряді випадків підвищується вміст ліпідів у сечі (ліпурія). Вона може виникати, наприклад, після їжі, особливо після прийому великої кількості риб'ячого жиру. Накопичення ліпідів у сечі відзначається при цукровому діабеті, туберкульозі легень, хворобах нирок, отруєннях, пухлинах підшлункової залози, інфекційних і гнійних процесах.
Гіполіпемія – зменшений вміст ліпідів у крові, спостерігається при цирозі печінки і зниженій функції щитовидної залози.
Недостатнє якісне і кількісне надходження ліпідів з їжею приводить до розвитку авітамінозів і гіповітамінозів жиророзчинних вітамінів. Так, зниження споживання з їжею рослинної олії приводить до появи ознак недостатності вітаміну F.
До захворювань, в основі яких лежать порушення обміну ліпідів, відносяться ожиріння, жирова дистрофія печінки, атеросклероз. У людей, що страждають на ожиріння, підсилюються процеси синтезу жирних кислот і триацилгліцеролів, що обумовлює їхнє накопичення і відкладення в клітинах. Жирова дистрофія печінки характеризується накопиченням надлишкової кількості триацилгліцеролів у її клітинах, що веде до дегенеративних змін клітин і порушенню їхніх функцій. У печінці активно відбувається обмін жирів, у тому числі два взаємозалежних процеси – синтез триацилгліцеролів і синтез фосфоліпідів. Посилення синтезу триацилгліцеролів гальмує утворення фосфоліпідів, і навпаки. При цьому триацилгліцероли легко відкладаються в печінкових клітках, а фосфоліпіди транспортуються до тканин, де беруть участь у різних процесах. При недоліку ліпотропних речовин, необхідних для синтезу фосфоліпідів, відбувається його гальмування, а жирні кислоти йдуть на синтез триацилгліцеролів, що накопичуються в клітках печінки, викликаючи її дистрофію.
Харчові речовини беруть участь у нормалізації порушень обміну ліпідів. Джерелами рухливих метильних груп, необхідних для синтезу ліпотропних речовин, є метіонін, вітаміни U, В15, холін, лецитин, бетаїн. На метилювання багатьох сполук впливають фолацин і вітамін В12.
В окисненні ліпідів, у тому числі холестеролу, до кінцевих продуктів беруть участь ніацин, триптофан, з якого частково утворюється ніацин при наявності вітаміну В6, В12, вітаміни С, Р, ліпоєва кислота, лецитин, холін.
Випаданню холестеролу в осад з рідких середовищ організму (зумовлюючому розвиток атеросклерозу, утворення жовчних каменів) перешкоджають поліненасичені жирні кислоти, що входять до складу рослинних олій. Важлива також їхня роль у зниженні формування ліпопротеїнів низкої щільності (які містять холестерол) і посиленні руйнування цих часток у крові. Вітамін С попереджає зменшення кількості ліпопротеїнів високої щільності, у складі яких холестерол швидше метаболізується, чим у частках низької щільності. Усмоктування цього ліпіду з кишечнику в кров гальмується b-ситостеролом, що міститься в рослинних жирах. Виведення холестеролу з організму через товсту кишку стимулюють вітаміни групи В (особливо тіамін), інозит, ПНЖК, а також магній, баластові речовини, сорбіт, ксиліт. Протисклеротичну дію мають деякі морепродукти внаслідок вмісту в них ПНЖК і йоду.
Дата добавления: 2015-10-05; просмотров: 6918;
