Энтропия, ее статистическое толкование
Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно δQ/T. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:
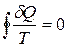 . (12.3)
. (12.3)
Из равенства нулю интеграла, взятого по замкнутому контуру, следует, что подынтегральное выражение δQ/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Таким образом,
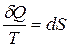 . (12.4)
. (12.4)
Функция состояния, дифференциалом которой является δQ/T, называется энтропиейи обозначается S.
Из формулы (12.3) следует, что для обратимых процессов изменение энтропии
ΔS = 0. (12.5)
В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает:
ΔS >0. (12.6)
Выражения (12.5) и (12.6) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Соотношения (12.5) и (12.6) можно представить в виде неравенства Клаузиуса
ΔS≥0, (12.7)
т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояние 2, то, согласно (12.4), изменение энтропии
ΔS1→2=S2 – S1= 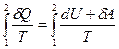 . (12.8)
. (12.8)
где подынтегральное выражение и пределы интегрирования определяются через величины, характеризующие исследуемый процесс. Формула (12.8) определяет энтропию, лишь с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропий.
Исходя из выражения (12.8), найдем изменение энтропии в процессах идеального газа. Так как dU=ν CVdT, δΑ=pdV=ν RT 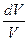 , то
, то
ΔS1→2=S2 – S1= ν CV 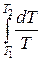 + ν R
+ ν R 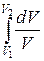 = ν
= ν 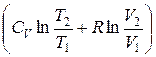 ,(12.9)
,(12.9)
т. е. изменение энтропии ΔS1→2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида процесса перехода 1→2.
Так как для адиабатического процесса δQ= 0, то ΔS=0 и, следовательно, S=const, т. е. адиабатический обратимый процесс протекает при постоянной энтропии. Поэтому его часто называют изоэнтропийным процессом. Из формулы (12.9) следует, что при изотермическом процессе (T1= Т2)
ΔS= ν 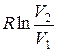 ,
,
при изохорном процессе (V1=V2)
ΔS= ν 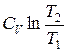 .
.
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Свойством аддитивности обладают также внутренняя энергия, масса, объем (температура и давление таким свойством не обладают).
Более глубокий смысл энтропии вскрывается в статистической физике: энтропия связывается с термодинамической вероятностью состояния системы.
Термодинамическая вероятность W состояния системы — это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние (по определению, W> 1, т. е. термодинамическая вероятность не есть вероятность в математическом смысле (последняя всегда< 1!)).
Согласно Больцману, энтропия системы и термодинамическая вероятность связаны между собой следующим образом:
S = k lnW, (12.12)
где: k – постоянная Больцмана. Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Формула Больцмана (12.12) позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы. В самом деле, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия – наиболее вероятного состояния системы — число микросостояний максимально, при этом макcимальна и энтропия.
Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии – принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор пока вероятность состояния не станет максимальной.
Сопоставляя выражения (12.7) и (12.9), видим, что энтропия и термодинамическая вероятность состояний замкнутой системы могут либо возрастать (в случае необратимых процессов), либо оставаться постоянными (в случае обратимых процессов).
Отметим, однако, что эти утверждения, имеют место для систем, состоящих из очень большого числа частиц, но могут нарушаться, в системах с малым числом частиц. Для «малых» систем могут наблюдаться флуктуации, т. е. энтропия и термодинамическая вероятность состояний замкнутой системы на определенном отрезке времени могут убывать, а не возрастать, или оставаться постоянными.
Дата добавления: 2015-10-05; просмотров: 1201;
