Уравнение Ван-дер-Ваальса
Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона – Менделеева pVm = RT (для моля газа), описывающее идеальный газ, для реальных газов непригодны.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик Ван-дер-Ваальс вывел уравнение состояния реального газа. В уравнение Клапейрона-Менделеева он ввел две поправки.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm,a Vm - b, где b – объем, занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d,т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
p/= 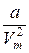 ,(9.1)
,(9.1)
где: а –постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm - молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа(уравнение состояния реальных газов):
(p+ 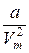 )(Vm-b)= RT.(9.2)
)(Vm-b)= RT.(9.2)
Для произвольного количества вещества ν газа (ν =m/M) с учетом того, что V=vVm, уравнение Ван-дер-Ваальса примет вид
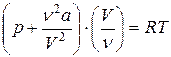
или (p+ v2a/V2)(V- νb) = vRT, где поправки а и b постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также приближенное, хотя и лучше (особенно для несильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Дата добавления: 2015-10-05; просмотров: 877;
