Законы идеального газа
Закон Бойля - Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
pV = const
при Τ = const, m = const. (7.1)
Кривая, изображающая зависимость между величинами р и V,характеризующими свойства вещества при постоянной температуре, называется изотермой.Изотермы представляют собой гиперболы, расположенные на графике (рис.7.1) тем выше, чем выше температура, при которой происходит процесс.
Законы Гей - Люссака: 1) объем данной массы газа при постоянном давлении изменяется линейно с температурой:
V = V0(1+αt),
 при p = const, и m = const; (7.2)
при p = const, и m = const; (7.2)
Рис.7.1. Рис.7.2. Рис.7.3.
2) давление данной массы газа при постоянном объеме изменяется линейно с температурой:
p = p0(1+ at)
при V = const, т = const. (7.3)
В этих уравнениях t – температура по шкале Цельсия, p0и V0— давление и объем при 0°С, коэффициент a= 1/273,15 К-1.
Процесс, протекающий при постоянном давлении, называется изобарным.На диаграмме в координатах V, t (рис.7.2) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме (рис.7.3) в координатах р, t он изображается прямой, называемой изохорой.
Из (7.2) и (7.3) следует, что изобары и изохоры пересекают ось температур в точке t= -1/a= -273,15 °С, определяемой из условия 1+at= 0. Если перенести начало отсчета в эту точку, то происходит переход к шкале Кельвина, откуда
Τ = t+1/a.
Вводя в формулы (7.2) и (7.3) термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:
V= V0 (1+at) = V0 [1+a (T-1/a)] = V0 aТ,
p = (1 + at) = р0 [1+a (T- 1/)] = p0 aТ
или
V1/V2= Т1/Т2
при р = const, m = const, (7.4)
р1/р2 = Т1/Т2
при V =const, m = const, (7.5)
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы.Принормальных условиях этот объем равен 22,41×10-3 м3/моль.
По определению, в одном моле различныхвеществ содержится одно и то же число молекул, называемое постоянной Авогадро:
NА =6,022 .1023 моль-1.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений р1, р2,···, рп, входящих в нее газов:
p = р1 + р2 + ... + рп.
Парциальноедавление – давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
7.3.Уравнение Клапейрона – Менделеева
 Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р,объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением: Рис.7.4.
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р,объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением: Рис.7.4.
F(p, V, T)=0,
где каждая из переменных является функцией двух других.
Французский физик и инженер Б. Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля - Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1, имеет давление р1и находится при температуре T1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами р2, V2, Т2(рис.7.4).
Переход из состояния 1 в состояние 2осуществляется в виде двух процессов: 1) изотермического (изотерма 1 – 1/ ), 2) изохорного (изохора 1/ – 2).
В соответствии с законами Бойля— Мариотта (7.1) и Гей-Люссака (7.5) запишем:
р1V1=p/1V2, (7.6)
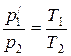 . (7.7)
. (7.7)
Исключив из уравнений (7.6) и (7.7) p/1 получим:
 .
.
Так как состояния 1 и 2были выбраны произвольно, то для данной массы газа величина pV/T остается постоянной, т. е.
pV/T = В = const. (7.8)
Выражение (7.8) является уравнением Клапейрона, в котором В — газовая постоянная, различная для разных газов.
Д. И. Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (7.8) к одному молю, использовав молярный объем Vm . Согласно закону Авогадро, при одинаковых p и Τ моли всех газов занимают одинаковый молярный объем Vm,поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной. Уравнению
pVm = RT (7.9)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клапейрона - Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (7.9), полагая, что моль газа находится при нормальных условиях (р0=1,013×105 Па, T0=273,15 К, Vm=22,41×10-3 м3/моль): R=8,31 Дж/(моль К).
От уравнения (7.9) для моля газа можно перейти к уравнению Клапейрона - Менделеева для произвольной массы газа. Если при некоторых заданных p и T один моль газа занимает молярный объем Vm, то масса т газа займет объем V=(m/М) Vm,где Μ – молярная масса (масса одного моля вещества). Единица молярной массы – килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массы т газа
pV = 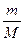 RT = vRT,(7.10)
RT = vRT,(7.10)
где: v=m/M — количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана
k=R/NA= 1,38∙10-23 Дж/К.
Исходя из этого, уравнение состояния (2.4) запишем в виде
p= RT/Vm = kNAT/Vm = nkT,
где NA/Vm=n — концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
p=nkT (7.11)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1м3 газа при нормальных условиях, называется числом Лошмидта:
Nl = р0/(kТ0)= 2,68∙1025 м-3.
Дата добавления: 2015-10-05; просмотров: 2638;
