Биосинтез насыщенных жирных кислот
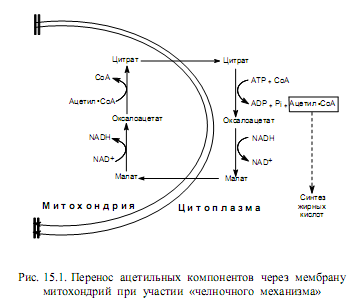
Биосинтез жирных кислот осуществляется в цитоплазме эукариотических клеток, у животных — в основном в клетках печени, жировой ткани, почек, легких. Непосредственным предшественником их синтеза является малонил-СоА, который образуется из ацетил-СоА. В свою очередь, основное количество ацетил-СоА образуется в матриксе митохондрий при окислительном декарбоксилировании пирувата, в процессе b-окисления жирных кислот, при расщеплении углеродных скелетов аминокислот. Будучи заряженным соединением, ацетил-СоА не может преодолеть мембранный барьер митохондрий, и для транспорта ацетильных групп в цитоплазму существует специальный «челночный механизм» (рис. 15.1). С помощью этого механизма ацетильные компоненты попадают в цитоплазму в составе цитрата, который расщепляется, образуя ацетил-СоА (при участии АТР и СоА) и оксалоацетат. Последний восстанавливается в малат и возвращается в матрикс митохондрий, где регенерируется цитрат.
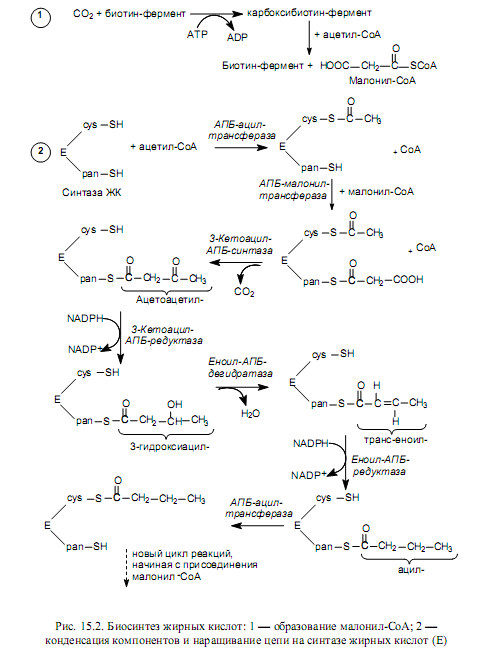
Оказавшись в цитоплазме, ацетил-СоА подвергается карбоксилированию с участием ключевого фермента биосинтеза жирных кислот—ацетил-СоА-карбоксилазы. В результате этой АТР-зависимой реакции формируется малонил-СоА (рис. 15.2). Простетической группой ацетил-СоА-карбоксилазы служит биотин. Он выполняет роль «подвижной руки», переносящей СО2 на молекулу ацетил-СоА. Реакция осуществляется в две стадии (рис. 15.2, см. также главу 7, рис. 7.7). Стадия образования малонил-СоА лимитирует скорость всего процесса синтеза жирных кислот, поскольку на уровне ацетил-СоА-карбоксилазы осуществляется регуляция данного пути: основным аллостерическим активатором фермента является цитрат. Этот метаболит образуется в митохондриях в большом количестве, когда там много ацетил-СоА, т. е. ЦТК перегружен «топливом», и его избыток должен запасаться в виде триацилглицеролов. В таком случае цитрат выходит в цитоплазму, выступая там одновременно в роли донора ацетил-СоА и активатора ацетил-СоА-карбоксилазы. Связывание цитрата с неактивными мономерами ацетил-СоА-карбоксилазы приводит к их соединению в нитевидный олигомер, который приобретает функциональную активность. Кроме этого, активность ацетил-СоА-карбоксилазы регулируется в ходе ковалентной модификации: понижается при фосфорилировании и повышается при дефосфорилировании.
Образующийся в цитоплазме малонил-СоА служит источником большинства атомов углерода в молекулах жирных кислот. Формирование пальмитиновой кислоты, включающей 16 атомов углерода, происходит согласно уравнению 15.1.
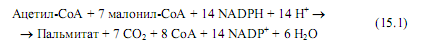
Удлинение цепи жирной кислоты происходит поэтапно, в ходе присоединения к ацетил-СоА двухуглеродных группировок, с участием сложной ферментной системы, называемой синтазой жирных кислот. Синтаза жирных кислот представляет собойгомодимер, т. е. состоит из двух идентичных полипептидных цепей, объединенных в комплекс. Каждая из двух частей может катализировать 7 последовательных реакций наращивания жирнокислотной цепи, при этом соблюдается согласованность действий частей и фермент активен только в виде димера.
В составе каждой части синтазы жирных кислот присутствуют необходимые для связывания субстратов сульфгидрильные группы. Одна SH-группа находится в составе фосфопантетеина (рис. 7.9) — простети-ческой группы одного из доменов синтазы, называемого ацилпереносящим белком (АПБ-белок). Вторая SH-группа принадлежит остатку цистеина в другом домене фермента — 3-кетоацил-АПБ-синтазе.
Активность мультиферментного комплекса пространственно распределена по нескольким доменам, которые участвуют в катализе семи реакций, требующихся для построения молекулы пальмитата и высвобождения продукта из комплекса с ферментом.
Первые этапы образования жирнокислотной цепи (рис. 15.2, 2) заключаются в переносе ацильного остатка на сульфгидрильную группу цистеина (cys-SH), а малонильного остатка — на сульфгидрильную группу фосфопантетеина (pan-SH). Оба остатка располагаются в молекуле синтазы (Е) довольно близко друг к другу. Когда обе SH-группы заняты ацильными остатками, происходит удлинение цепи вследствие переноса ацильного компонента на второй атом углерода малонильного остатка, в ходе чего происходит отщепление карбоксильной группы в виде СО2. Это та молекула углекислоты, которая включилась в состав малонил-СоА при карбоксилировании ацетил-СоА. Таким образом, фиксация СО2 (включение в состав органического вещества) при биосинтезе жирных кислот не происходит! Декарбоксилирование необходимо, чтобы сдвинуть равновесие реакции вправо, поскольку при отщеплении СО2 резко возрастает реакционная способность оставшегося ацетильного компонента, который легко конденсируется с остатком ацетил-СоА, присоединенным к SH-группе фосфопантетеина. Следующие три реакции представляют собой восстановление 3-кетогруппы, дегидратацию и восстановление двойной связи в остатке еноила. После этого ацилтрансфераза переносит ацильный остаток (промежуточный продукт, результат удлинения цепи на 2 атома углерода) на SH-группу цистеина, а освободившаяся SH-группа фосфопантетеина готова вновь акцептировать малонильный остаток.
После семи таких циклов формируется 16-углеродный пальмитоил, связанный с сульфгидрильной группой фосфопантетеина. Его распознает и отщепляет от синтазы ацил-АПБ-гидролаза, в среду высвобождается конечный продукт — пальмитиновая кислота.
Пальмитиновая кислота используется в качестве предшественника для синтеза других насыщенных жирных кислот с более длинной цепью. Эти процессы осуществляются у эукариот в митохондриях и в эндоплазматическом ретикулуме. К активированным СоА-эфирам жирных кислот добавляются ацетильные остатки, донорами которых служит ацетил-СоА или малонил-СоА.
Дата добавления: 2015-09-29; просмотров: 1169;
