Молекулалық физика және термодинамика
Молекулалық физиканың негізіне заттың молекулалық құрылысы туралы болжам алынады. Бұл гипотеза бойынша зат үздіксіз және шексіз бөлінбейді. Заттың барлық қасиетін сақтайтынең кішкентай бөлшегін молекула деп атайды. Молекулалардың қозғалысы көзге көрінбейді.
Зат құрылысының алғашқы элементтеріне: зат мөлшері, мольдік масса, Авогадро саны сияқты ұғымдар біріктіріледі.
Зат мөлшері – заттың белгілі массасындағы құрылымдық элементтері санымен сипатталады. Құрылымдық, элементтеріне атомдар, молекулалар, иондар жөне т.б. бөлшектер немесе арнайы бөлшектер тобы жатуы мүмкін. СИ жүйесіндегі зат мөлшерінің өлшем бірлігі моль деп аталады. Мольдер саны  (ню) символымен белгіленеді.
(ню) символымен белгіленеді.
Массасы 0,012 кг 12С көміртегі изотопында қанша атом болса, сонша құрылымдық элементтеріне ие жүйедегі заттың мөлшері мольге тең деп алынады. Сондықтан, анықтамасы бойынша кез келген заттың бірлік мөлшерінде (бір мольде) құрылымдық элементтер саны бірдей. Осы санды Авогадро тұрақтысы немесе Авогадро саны деп атайды. Бұл тұрақты итальян ғалымы А.Авогадро құрметіне аталған, белгісі 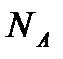 Авогадро тұрақтысы іргелі физикалық тұрақтылар қатарына кіреді. Оның мәні
Авогадро тұрақтысы іргелі физикалық тұрақтылар қатарына кіреді. Оның мәні
 (1)
(1)
Мольді өндіретін эталон болмайды, молекулалық шамалар өлшенбейді, олар есептеледі. Осы (1)-ші өрнектен мынадай анықтама шығады:
 (2)
(2)
Заттың бір молінің массасын мольдік масса деп атайды. Мольдік массаны М әрпімен белгілейді. (1)-ші формуланы қолданып, мольдік масса бір молекуланың массасы мен Авогадро санының көбейтіндісіне тең болатындығын көреміз:
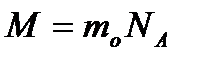 (3)
(3)
 (4)
(4)
Егер газдың N молекуласы болса, онда мольдер саны  былай табылады:
былай табылады:
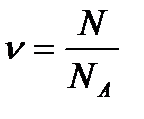 (5)
(5)
Осы теңдеуді молекула массасына көбейтіп, массасы  заттың мольдер саны
заттың мольдер саны
 (6)
(6)
екендігін байқаймыз, осыдан
 (7)
(7)
болады.
Мұндай есептеулер жүргізгенде элементтердің салыстырмалы атомдық массасы Менделеевтің элементтер периодтық жүйесінен алынады.
Молекулалық физика мен термодинамикада негізінен: идеал және реал газ деп аталатын екі физикалық модельдер қолданылады.
Идеал газ:
– жеке молекуланың көлемі газ құйылған ыдыс көлеміне қарағанда ескерусіз;
– газ молекулаларының арасында өзара әсерлесу күші болмайды;
– газ молекулалары бір-бірімен және ыдыс қабырғасымен абсолютті серпімді соқтығысады.
Бұл модельді қалыпты жағдайдағы немесе өте төменгі қысыммен жоғарғы температурадағы реал газдар үшін де қолдануға болады.
Термодинамика немесе жылудың жалпы теориясы аксиоматикалық ғылым болып табылады. Ол заттың құрылымы және жылудың физикалық табиғаты жайлы ешқандай арнаулы гипотезаларды да, нақты көзқарастарды да пайдаланбайды. Оның қорытындылары тәжірибе деректерін жалпылауға негізделген принциптер мен болжамдарға сүйенеді. Ол жылуды қандай да бір ішкі қозғалыстардың жиынтығы деп қарастырады. Оның қандай қозғалыс екендігінде шаруасы болмайды. Сондықтан молекулалық физиканы зат құрылымының молекулалық-кинетикалық теориясы (МКТ) деп атайды.
Термодинамикада макроскопиялық жүйелердің күйлерін зерттеу үшін термодинамикалық және статистикалық әдістер деп аталатын екі зерттеу әдістері қолданылады.
Термодинамикалық әдіс заттың атомдық-молекулалық құрылымы туралы ешқандаймодельді көзқарастарға сүйенбейді және өзінің мәні бойынша феноменологтық (гректің рһаnоmеnоn - көрінетін, білінетін) болады. Термодинамикалық әдістің міндеті - тікелей тәжірибеде бақылайтын шамалардың (қысым, температура, көлем, концентрация және т.б.) арасындағы байланысты тағайындау. Кез келген физикалық мәселедерді шешу кезінде термодинамикалық әдісті колданғанда, онда заттың атомдық-молекулалық құрылымымен байланысты ешқандай шамалар (атом мен молекула өлшемдері, олардың массасы және т.б.) қарастырылмайды.
Термодинамиканың жалпылығы ерекше, оны қарапайым механизмдер мен адам организмін зерттеуге де қолдануға болады. Бұдан басқа, осы теорияның шеңберінде өзіміздің күнделікті өмірдегі тәжірибенің біразын түсінуге болады. Неге кеседегі ыстық шай суиды? Неге әтірдің иісі барлық бөлмеге таралады деген сияқты.
Термодинамикалық әдістің күші, оның әр түрлі заттың тікелей байқалатын қасиеттерінің арасындағы қатынастарды, олардың ішкі құрылымы туралы ештеңе білмей-ақ тағайындауда білінеді. Орасан зор сан молекулалардан құралған күрделі жүйелер туралы мәліметті, тек қана төрттен артық емес, негізгі термодинамикалық заңдар мен бірнеше айнымалы шамаларға сүйеніп алуға болады. Термодинамиканың тағы да бір артықшылығы, оның қорытындылары қарастырып отырған жүйенің өзгешелігіне тәуелді емес. Мысалы, біз тастың температурасы деп, немесе жәндіктің, немесе адамныңқолының температурасы жайында пікір айта аламыз. Тас, жәндіктің денесі, адамның қолы жылулық тепе-теңдікте болатын қасиетке ие. Заттың арнайы табиғи ерекшелігі теорияда бірнеше параметрлер арқылы белгіленеді, мысалы жылусыйымдылық, мольдік көлем деген сияқты. Осы әдіс негізінде екі әр түрлі күйдегі жүйелердің қасиеттері туралы мәліметтер алуға мүмкіндік шығады.
Тепе-теңдік термодинамикасы жүйені тыныштықкүйінде бейнелейді, оны көрнекі түрде былай сипаттауға болады "осында және қазір", ол жүйенің бұрынғы жайтын және алғашқы күйден соңғы күйге өту жолын ескермейді.
Статистикалық әдіс термодинамикалық әдіске қарама-қарсы, ол бастан макроскоптық жүйелердің қасиеттерін зерттегенде модельдік атомдық-молекулалық көзқарастарға негізделген. Статистикалық әдістің мақсатын былай тұжырымдауға болады: заттың макроскоптық мөлшерінің қасиеттерінің өзгерісі заңын тағайындау үшін, оның құрамындағы бөлшектердің (молекула, атом, ион және т.б.) қозғалыс заңдарын білу қажет. Сондықтан статистикалық физика термодинамика заңдарының теориялық дәлелдеуін атомдық-молекулалық тұрғыдан көрсетеді.
Жалпы жағдайда осы екі әдіс бір-біріне ұштасып, бірлестірілген статистикалық термодинамика әдісін құрастырады.
Молекулалық физиканың дамуының өте маңызды кезеңі кинетикалық теориямен байланысты. Кинетикалық деген ұғым қозғалысқа қатысы бар дегенді білдіреді, сондықтан құбылыстарды зерттеу үшін, олардың динамикалық сипаттарға қатысты екенін көрсетеді. Жылудың кинетикалық теориясы бойынша молекулалар шапшаң немесе баяу қозғалады, егер олар құрамына кіретін дене ыстығырақ немесе суығырақ болса. Жылулық энергиясы дененің шындығында оның құрамындағы көзге көрінбейтін молекулалық қозғалыстың денеге қатысты тұтас механикалық (кинетикалық және потенциалдық) энергиясы болып келеді. Осы түсінік бойынша жылулық энергия құрамына молекулалардың ілгерілемелі қозғалысының кинетикалық энергиясы және молекула құрылымындағы атомдардың айналмалы кинетикалық энергиясы мен тербелісінің кинетикалық және потенциалдық энергиясы кіреді. Осыдан, “молекулалардың жылулық қозғалысы” деген термин (латынның terminus - ғылымда қолданатын белгілі ұғымды дәл белгілейтін сөз) шығады.
Молекулалық гипотеза мен жылулық кинетикалық теориясы заттың кез келген күйіне қолданылады. Заттың үш агрегаттық (латынның aggrego - қосыламын) күйлері – қатты, сұйық және газ тәріздес молекулалардың жақындық дәрежесі мен қозғалыстарының қарқындылығымен айырылады. Қатты денеде бөлшектер бір-бірімен тығыз жанасады, сондықтан өте сирек жағдайда олардың кейбіреуі көршілері арасымен сырғанап орын ауыстыруы мүмкін. Қатты денені қыздырғанда молекулалар қозғалысы үдейді, ол дененің жылулық ұлғаюына әкеледі. Бір мезгілде сыртқы қысымға байланысты бір-біріне тығыз жабысқан молекулаға бір топтан екінші топқа ауысуына мүмкіншілік туады. Осы жағдай заттың сұйық күйгеауысуына мүмкіндік береді, одан арғы қыздыру молекулалардың өзара байланыс күшін үзіп, оларға еркін қозғалуға мүмкіншілік туғызады, сондықтан молекулалар кез келген қолайлы кеңістікті жайлайды; зат газ тәріздес күйге ауысады.
Қысым мен температураның бір мәндерінде заттың екі фазасы (сұйық пен газ, қатты мен сұйық немесе қатты мен газ тәріздес) бірге қатар тепе-теңдік күйде бола, өмір сүре бастайды. Тек бір белгілі қысым мен температура мәнінде заттың барлық үш фазасы бірте тепе-теңдік күйде катар өмір сүре алады. Күй диаграммасындағы осы нүктені үштік нүкте деп атайды.
Газдың тығыздығы сұйық немесе қатты күйдегі заттың тығыздығымен салыстырғанда кіші болады. Сондықтан газдың молекулаларының арақашықтығы, олардың өлшемдерінен әлдеқайда үлкен. Қозғалыстағы молекулалар бір-біріне әлсіз әсер етеді, тек жакындасқанда жолдары алғашқы бағыттарынан елеулі ауытқуы мүмкін. Бұл жағдайда молекулалар бір-бірімен соқтығысты дейді.
Сонымен, молекула-кинетикалық теория заттың күйлерін және ондағы байқалатын құбылыстарды молекулалар арасында әсер ететін күштермен байланыстырады. Молекулааралық күштердің табиғаты эксперименттік зерттеулер мен теориялық болжаулар нәтижесі арқылы айқындалады. Мысалы, газдардың сұйыққа айналуы, үлкен қашықтықтарда молекулалар арасында тартылыс күштері, ал сұйықтың сығылуға қатты карсылығы, жақын қашықтықта тебу күштері болатынын дәлелдейді және қашықтыққа қатысты бұл күштер қатты өзгереді.
Молекулааралық күштерді жақыннан әрекеттесу және алыстан әрекеттесу деген екі топқа бөледі. Жақыннан әрекеттесу күштерін валенттік күштер немесе химиялық күштер деп те атайды. Молекулалар соншалықты жақындасқанда, тіпті олардың сыртқы электрондық бұлттары бүркелген кезде, тебу күштері пайда болады. Молекулалық өлшемдерінен үлкен қашықтықта молекулалар бірін-бірі тарта бастайды, демек тартылыс күштер пайда болады.
Молекулалық физика мен термодинамикада өте көп молекулалардан тұратын жүйе қасиеттері зерттеледі.
Термодинамикалық жүйе деп өзара және сыртқы қоршаған ортамен энергия және масса алмасуға қабілетті денені немесе денелер жиынтығын айтады.
Кез келген материялық дене орасан көп микробөлшектерден және молекулалардың үлкен жиынтығынан тұрады. Мұндай денелерді макроскоптық жүйе дейді. Макроскоптық жүйелердің өлшемдері әрқашан да атом мен молекула өлшемдерінен едәуір үлкен.
Термодинамикалық жүйені сипаттайтын барлық макроскоптық белгілерін макроскоптық параметрлер деп атайды. Оларға, мысалы тығыздық, көлем, қысым, концентрация және т.б. жатады.
Макроскоптық параметрлер сыртқы және ішкі болып бөлінеді. Қарастырып отырған жүйеге кірмейтін сырттағы денелердің макро- сипаттары сыртқы параметрлерге жатады.
Термодинамикалық жүйенің күйін тәуелсіз макроскоптық параметрлер жиынтығы анықтайды. Жүйенің бұрынғы өткен жайттарына тәуелсіз және тап осы кездегі күйін толық анықтайтын шамаларды күй функциялары дейді.
Егер жүйенің параметрлері уақыт бойынша өзгермесе, оның күйін
стационарлық деп атайды.
Сонымен, жүйенің термодинамикалық күйін, оның барлық қасиеттерінің жиынтығы анықтайды.
Термодинамикалық жүйе деп термодинамикалық тепе-теңдік күйде болатын макрожүйелерді айтады. Тепе-теңдік күйдегі жүйені сипаттайтын шамаларды P, V, T термодинамикалық параметрлер деп атайды.
Жүйенің бір күйден екінші күйге өтуі, жүйенің тепе-теңдік күйден шығуымен байланысты болады. Демек, жүйе қандай да бір жүрген кезде тепе-теңдік емес күйлерінің тізбегінен өтеді.
Тепе-теңдік күйлердің үздіксіз тізбегінен құрылған тепе-теңдік деп аталады. Тепе-теңдік кезінде жүйенің барлық макропараметрлері өте баяу, физикалық шектеусіз баяу, болымсыз өзгереді, әр түрлі нүктелеріндегі параметрлердің мәні, мысалы қысым болса, қайсыбір орташа 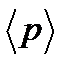 мәніне жақын болады. Бұл айтылғандардан, тек шектеусіз баяу өтетін тепе-теңдік бола алады.
мәніне жақын болады. Бұл айтылғандардан, тек шектеусіз баяу өтетін тепе-теңдік бола алады.
Егер тепе-теңдік күйінен жүйе шығарылып және еркіне жіберілсе, онда ол біраз уакыттан кейін қайтадан тепе-теңдік күйіне оралады. Жүйенің тепе-теңдіксіз күйінен тепе-теңдік күйіне өту процесі релаксация деп аталады, aл жүйенің тепе-теңдік күйге оралу уақытын релаксация уақыты дейді.
Термодинамикалық жүйеде өтетін процестің жылдамдығы релаксация жылдамдығынан едәуір кіші делік, онда бұл процестің кез келген кезеңінде барлық параметрлер мәндері теңеліп үлгереді. Сондықтан мұндай бір-біріне шексіз жақын тепе-теңдік күйлердің тізбегінен тұрады. Осындай жеткілікті баяу процестерді квазистатикалық немесе тепе-теңдік деп те атайды.
Жүйелердің күйлері мен процестерін бейнелеу үшін графиктік әдісті қолданады. Біртекті жүйе күйлері нүктелермен белгіленеді, ал процестерді 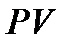 ,
,  және т.б. жазықта сәйкес сызықтар бейнелейді. Айта кету керек, тек қана тепе-теңдік күйлер мен процестерді графиктік бейнелеу мүмкін. Осындай да тепе-теңдік күй әр мезетте макропараметлердің белгілі бір мәнімен сипатталатын болады.
және т.б. жазықта сәйкес сызықтар бейнелейді. Айта кету керек, тек қана тепе-теңдік күйлер мен процестерді графиктік бейнелеу мүмкін. Осындай да тепе-теңдік күй әр мезетте макропараметлердің белгілі бір мәнімен сипатталатын болады.
Тепе-теңдік күй және тепе-теңдік ұғымдары молекулалық физикада маңызды орын алады.
Әрине, барлық нақты процестер тепе-теңдіксіз, сондықтан олар тепе-теңдік күйге белгілі дәрежеде жуықтауы мүмкін. Сондықтан тепе-теңдік процесі уақыт бойынша қайтымды. Жүйе тура бағытта кандай күйлерден өтсе, кері процесте сондай күйлер тізбегінен өтуі қажет. Осындай тепе-теңдік процестерді қайтымды теп атайды. Мысалы, жүйе ABC өзгерістерге ұшырады делік (1- сурет). Бұл өзгерістер қайтымды болады:
а) егер кері СВА бағыттағы өзгерістер сондай алдындағы тура бағыттағы мәндеріне сәйкес келсе;
б) қоршаған ортамен не жылу, не затпен алмасып және жұмыс өндірсе, онда кері бағыттағы процестің СВА бөліктерінде сондай мөлшерде жүйе жылу шығарады да, жұмыс орындалады. Мысаяы, ABC жолында жүйе  жылу мөлшерін алды делік, онда кері СВА-мен қайтқанда, ол тура сондай
жылу мөлшерін алды делік, онда кері СВА-мен қайтқанда, ол тура сондай  мөлшерде жылуды шығаруы қажет.
мөлшерде жылуды шығаруы қажет.
| V |
| P |
| A |
| C |
| Q |
| Q1 |
| B |
1 - сурет
Осы екі шарттарды қанағаттандырмайтын өзгерістердің барлығы қайтымсыз процестер деп аталады. Табиғатта өтетін барлық процестер қайтымсыз.
Тығыздық
Термодинамикалық жүйенің 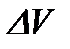 көлеміндегі қасиетінің мөлшерін
көлеміндегі қасиетінің мөлшерін  деп белгілейік.
деп белгілейік.  көлемдегі қасиеттің
көлемдегі қасиеттің 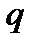 тығыздығын
тығыздығын 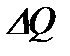 мөлшерін осы көлемнің
мөлшерін осы көлемнің 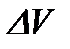 шамасына қатынасы түрінде анықтайды:
шамасына қатынасы түрінде анықтайды:
 . (8)
. (8)
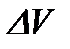 жүйенің толық V көлемінің бөлігі, сондықтан қасиеттің мөлшерін (8) өрнекті интегралдау арқылы табамыз:
жүйенің толық V көлемінің бөлігі, сондықтан қасиеттің мөлшерін (8) өрнекті интегралдау арқылы табамыз:
 , (9)
, (9)
мұндағы dV – жүйенің шексіз кішкене бөлігінің көлемі.
 көлемдегі газ массасы
көлемдегі газ массасы 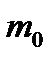 біркелкі молекуладан құралған делік. Молекулалар саны N .Онда (6) өрнегін қолданып, газдың
біркелкі молекуладан құралған делік. Молекулалар саны N .Онда (6) өрнегін қолданып, газдың  көлеміндегі массасын былай табамьз:
көлеміндегі массасын былай табамьз:
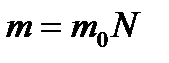 . (10)
. (10)
Бірлік көлемдегі газдың массасының тығыздығын 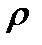 деп белгілейді. Онда (8) және (10) өрнектерге сүйеніп,
деп белгілейді. Онда (8) және (10) өрнектерге сүйеніп,
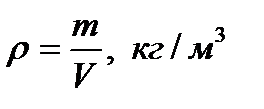 (11)
(11)
деп жаза аламыз.
Бірлік көлемдегі молекулалар саны немесе сандық тығыздығы (8) бойынша мынаған тең болады:
 (12)
(12)
 және
және 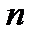 байланысты, оны (10) және (11) өрнектерін ескеріп, анықтаймыз:
байланысты, оны (10) және (11) өрнектерін ескеріп, анықтаймыз:
 (13)
(13)
Осыдан, массалық тығыздық бір молекула массасын сандық тығыздыққа көбейту арқылы анықталады және ол бірлік көлемдегі молекулалар санына тура пропорционал болады. Егер заттың  тығыздығы белгілі болса, онда (9) формула бойынша барлық
тығыздығы белгілі болса, онда (9) формула бойынша барлық  көлемдегі оның толық массасы
көлемдегі оның толық массасы
 (14)
(14)
болатындығы анық.
Егер заттың қасиеті оның бірлік массасына қатысты анықталса, онда оны меншікті қасиет деп атайды. Мысалы, меншікті көлем  төмендегі өрнек арқылы табылады:
төмендегі өрнек арқылы табылады:
 (15)
(15)
мұндағы  – газдың көлемі,
– газдың көлемі, 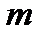 –газдың массасы.
–газдың массасы.
(11) ескерсек, онда меншікті көлем 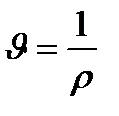 тығыздыққа керіпропорционал болады.
тығыздыққа керіпропорционал болады.
Заттың бір моліндегі қасиеті мольдік деп аталады. Мысалы, мольдік масса немесе мольдік көлем. Температурасы мен қысымы бірдей идеал газдардың мольдік көлемдері бірдей болады. Мысалы, қалыпты жағдайда, температура  және қысымы 760 мм сын.бағ. болғанда, бір моль идеал газдың көлемі
және қысымы 760 мм сын.бағ. болғанда, бір моль идеал газдың көлемі  болады.
болады.
Концентрация
Жалпы жағдайда кез келген агрегаттық күйде бір зат екінші заттың ортасында немесе бірнеше заттардың ішінде бірқалыпты бөлініп таралуы мүмкін. Мұндай заттың араласуына газдар қоспасы, сұйықтар ерітіндісі, қатты денелер ерітіндісі (қорытпалар) және аралас кристалдар жатады.
Бірнеше заттың араласуын бір заттың молекулаларының екіншісінің ішінде қарапайым таралуы ден түсінуге болмайды, негізінде мұндай араласу әр түрлі молекулааралық әрекеттесулерге байланысты болады.
Қоспа (ерітінді, қорытпа) құрамындағы затты компонент (латынның соmponens - құраушысы) деп атайды. Қоспаның қосылыс сандық құрамын әр түрлі тәсілдер арқылы анықтайды. Қоспаның бірлік массасындағы немесе бірлік көлеміндегі зат компоненттерінің мөлшерін концентрация деп атайды. Концентрация әдетте, қоспаның компоненттерінің салыстырмалы мөлшерін сипаттайтын шама болады. Сондықтан, ол процентпен немесе компоненттің массалық немесе мольдік үлесімен анықталуы мүмкін.
Қоспадағы заттың физикалық қасиеттері компоненттердің қасиеттерімен тығыз байланысты. Сол себептен қоспадағы заттың концентрациясын білуіміз өте қажет.
Молекулалық физикада концентрацияның бірнеше түрлері қолданылады.
Осы айтылғандардан (11) және (12) өрнегімен анықталған массалық және сандық тығыздықтар көлемдік концентрация қатарына жатады. Мұндай концентрациялардың өлшем бірліктері болады. Мысалы, 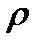 массалық тығыздықтың бірлігі
массалық тығыздықтың бірлігі 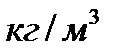 , ал
, ал 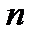 – сандық тығыздықтың –
– сандық тығыздықтың –  болады.
болады.
Көптеген физикалық мәселелерді қарастырғанда өлшемсіз концентрацияны қолдану ыңғайлы.
Қоспадағы  - компоненттің мольдік үлесі немесе салыстырмалы мольдік концентрациясы
- компоненттің мольдік үлесі немесе салыстырмалы мольдік концентрациясы  деп, осы компоненттің
деп, осы компоненттің 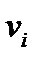 мольдер санының барлық қоспаның компоненттерінің мольдер санына
мольдер санының барлық қоспаның компоненттерінің мольдер санына
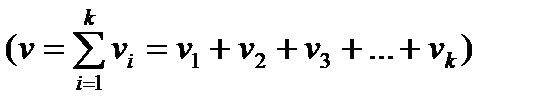 қатысы арқылы анықталатын шаманы айтады, демек
қатысы арқылы анықталатын шаманы айтады, демек

немесе
 (16)
(16)
мұндағы 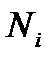 –
–  компоненттің бөлшектер саны,
компоненттің бөлшектер саны,  – жалпы молекулалар саны,
– жалпы молекулалар саны, 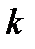 - компоненттер саны.
- компоненттер саны.
Идеал газдар қоспасы үшін мольдік үлесі компоненттердің парциал қысымдары 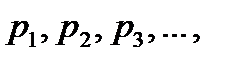 және қоспаның жалпы қысымы
және қоспаның жалпы қысымы 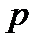 арқылы анықталуы мүмкін:
арқылы анықталуы мүмкін:
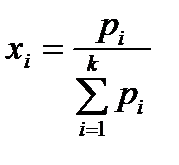 (17)
(17)
Қоспаға кіретін заттың қайсыбір компонентінің дәл сол қоспадағыдай мөлшерде ыдыста жалғыз өзі калған кездегі рі қысымы, газ қоспасының сол компонентінің парциал қысымы деп аталады. Онда, газ қоспасының жалпы р қысымы қоспаның компоненттерінің парциал қысымдарының қосындысына тең болады:
 (18)
(18)
Сөйтіп, идеал газ қоспасының жалпы қысымы (18)-ші формуламен анықталады, оны Дальтон заңы дейді.
Идеал газдың қоспалары да кәдімгі идеал газ болып келеді.
Осы айтылғаннан, идеал газ қоспасының кез келген компонентінің парциал қысымы, оның қоспадағы мольдік үлесінің қоспаның жалпы қысымының көбейтіндісіне тең болады:
 (19)
(19)
Салыстырмалы мольдік концентрациясы бірлік көлемдегі  молекулалар саны арқылы есептеуге болады:
молекулалар саны арқылы есептеуге болады:
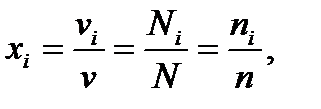 (20)
(20)
мұндағы  .
.
Кең тараған  – компоненттің массалық үлесі немесе салыстырмалы массалық концентрациясы былай анықталады:
– компоненттің массалық үлесі немесе салыстырмалы массалық концентрациясы былай анықталады:
 (21)
(21)
мұндағы 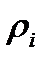 –
–  компоненттің тығыздығы,
компоненттің тығыздығы, 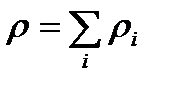 – қоспаның тығыздығы.
– қоспаның тығыздығы.
Қоспаның салыстырмалы концентрациясының қосындысы бірге тең болады, демек
 немесе
немесе 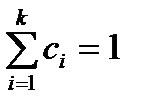 (22)
(22)
Қоспалардың қасиеттерін қарастырғанда әр түрлі араласу ережелерін қолданады.
Мысалы, қоспаның құрамында екі компонент бар делік, онда  қоспаның тығыздығын таза компоненттердің
қоспаның тығыздығын таза компоненттердің  және
және 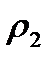 тығыздықтары арқылы былай анықтауға болады:
тығыздықтары арқылы былай анықтауға болады:
 . (23)
. (23)
Қоспадағы  компоненттің мольдік көлемдік концентрациясы мына түрде анықталады:
компоненттің мольдік көлемдік концентрациясы мына түрде анықталады:
 (24)
(24)
мұндағы,  – газдың көлемі,
– газдың көлемі, 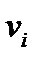 –
–  компоненттің мольдер саны.
компоненттің мольдер саны.
Идеал газдың қоспалары үшін заттың көлемдік және салыстырмалы мольдік концентрациялары дәл келеді.
Молекула-кинетикалық теорияның негізгі теңдеуін шығару үшін алдымен мынадай мәліметтер қолданылады:
– бір атомды идеал газ қарастырылады;
– газ молекулалары ретсіз қозғалады. Оның қозғалысының барлық бағыты бірдей деп алынады;
– газ молекулаларының өзара соқтығысу саны, олардың ыдыс қабырғасымен соқтығысу санына қарағанда өте ескерусіз аз;
– молекулалардың ыдыс қабырғасына соқтығысуы абсолютті серпімді;
– молекулалардың ретсіз қозғалысын есептеу үшін қозғалыс бағыттары өзара перпендикуляр координата осьтерінің бойында ілгерлемелі қозғалысқа түседі деп жориды. Уақыттың кез-келген мезетінде бір бағытта барлық молекулалардың 1/3 оның ішінде 1/6 молекулалар тура бағытта, ал 1/6 молекулалар кері бағытта қозғалады деп есептеледі.
– барлық молекулалардың жылдамдығы бірдей 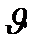 тең деп алынады.
тең деп алынады.
Ойша газ құйылған ыдыс ішінен табан ауданы 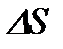 , жасаушысы
, жасаушысы  тең болатын тік цилиндрді бөліп алайық.
тең болатын тік цилиндрді бөліп алайық.
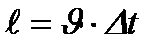
|

|
2 - сурет
Сонда, бір бағытта қозғалатын молекулалардың саны

мұндағы  - молекула концентрациясы.
- молекула концентрациясы.
Сонда N молекулалардың ыдыс қабырғасына соқтығысқан кездегі оған беретін импульсі
 (25)
(25)
мұндағы  - молекула массасы.
- молекула массасы.
Газ молекулаларының ыдыс қабырғасына түсіретін қысымы
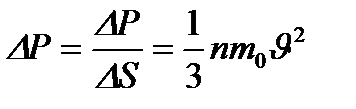 (26)
(26)
Егер идеал газдың 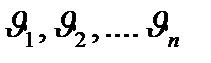 жылдамдықпен қозғалатын иолекула болса, онда олардың орташа квадраттық жылдамдығы
жылдамдықпен қозғалатын иолекула болса, онда олардың орташа квадраттық жылдамдығы

Сонда идеал газдың МКТ негізгі теңдеуін жазайық
 (27)
(27)
оны әрі қарай түрлендірсек, онда
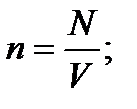
қысым

немесе
 (28)
(28)
және
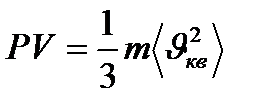 (29)
(29)
немесе
 (30)
(30)
Бұл (27), (28), (29), (30) теңдеулерді МКТ негізгі теңдеулері деп атайды.
Температура. Температура түсініктемесі. Жылулық тепе-теңдік.
Молекула-кинетикалық теорияның негізгі тендеуі бойынша идеал газдың қысымы, оның 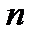 сандық тығыздығына және молекулалардың ілгерілемелі қозғалысының орташа кинетикалық энергиясына пропорционал болады.
сандық тығыздығына және молекулалардың ілгерілемелі қозғалысының орташа кинетикалық энергиясына пропорционал болады. 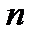 тұрақты болғанда, газ массасының көлемі өзгермеген кезде.
тұрақты болғанда, газ массасының көлемі өзгермеген кезде.
Тәжірибеден белгілі, тұрақты көлемдегі газдың қысымын бір ғана тәсілмен өзгертуге болады: немесе қыздырып, немесе суытып. Газды қыздырғанда оның қысымы өседі, ал суытқанда төмендейді. Бұл айтылғандарды тікелей тәжірибеде бақылауға болады. Кез келген заттың ыстық немесе суық болуын сипаттайтын ерекше шаманы температура деп атайды. Онда температура заттың жылулық қасиетін сипаттайтын шама болатындығы анық.
Осы айтылғандардан температура заттың құрамындағы жеке молекулалардың орташа кинетикалық энергиясымен байланысты болуын сеземіз. Физикалық шаша ретінде температураның ерекшелігін қарапайым тәжірибеден байқауға болады. Жылылығы әр түрлі бірнеше денелерді қатарлап қоюға болады. Мысалы, бізге судың буы судың (сұйық) өзінен ыстығырақ, ал мұздан жылы көрінеді. Бір жағынан, осы заттар бір-бірімен түйісетін болса, онда олардың температуралары теңеле бастайды, демек жылылығы бірдей болып, жылулық тепе-теңдік күйге келеді. Термодинамиканың нөлдік заңы осы қасиетпен негізделеді. Егер бір-біріне тәуелсіз екі А және В денелер жеке-жеке үшінші С денемен жылулық тепе-теңдікте болса, онда олар бір-бірімен дәл осындай жылулық тепе-теңдікте болады. Басқаша айтқанда жылулық тепе-теңдік жүйенің барлық нүктелерінде температурасы тең болатынын анықтайды. Бұл заң термодинамиканың нөлдік заңы деп аталады.
Физикалық шама ретінде температураны басқа параметрлермен салыстырғанда, оның өзгешелігі бар. Ол өзгешелік температураның аддитивтік шама еместігі. Кезкелген денені ойша бірнеше бөлікке бөлейік, онда тұтас дененің температурасы, оның бөліктерінің температураларының қосындысына тең болмайды. Мысалы, дененің көлемінің барлық бөліктерін қосып есептеуге болады, демек көлем аддитивтік шама.
Температураны өлшеу тәсілдері көне заманнан белгілі. Бұл тәсілдер заттың температурасыш өзгергенде оның қасиеттері өзгеретінін пайдаланады.
Онда заттыңшн қасиеттерін сипаттайтын шамалар да температура өзгергенде өзгереді. Заттың температурасын өзгерту, оның барлық физикалық қасиеттеріне әсер етеді: сызықтық өлшемдері, олардың серпімділік қасиеттері, өткізгіштердің электрлік кедергілері және т.б. өзгереді. Осы өзгерістердің кезкелгенін температураны өлшеу үшін қолдануға болады.
Сондықтан, температураны өлшейтін аспапты, яғни термометрді жасау үшін, қасиеті температураға байланысты үздіксіз және бірсарынды өзгеретін қандай да бір затты таңдайды, оны термометрлік зат деп айтады. Оған қоса заттың қасиетін сииаттайтын белгілі бір шаманы, демек термометрлік шаманы, таңдап алуымыз қажет. Мысалы, термометрлік зат – сынап, онда термометрлік шама ретінде оның көлемін алуға болады. Сынаптың көлемінің өзгерісі температураға тура пропорционал, демек сызықтық түрде өзгереді деп есептеледі. Сұйықтың көлемінің температурағақатысты өзгеруі көптеген термометрлерде қолданады.
Термометрлік шаманың температураға тәуелділігін сандық түрде сипаттау үшін, температураның өлшем бірлігін енгізуіміз керек. Температураның өлшем бірлігі ретінде "градус" (латынның gradus - адым) тағайындалған. Ол былай анықталады. Еркін түрде алынған екі температура аралығын алып, оны градус деп аталатын бірдей бөліктерге бөлеміз де, температураның біреуіне белгілі бір сандық мән тағайындаймыз. Осы арқылы екінші температураның және аралықтағы кез келген температуралардың мәнін анықтауға болады. Сөйтіп, температуралық шкала құрылады.
Мысалы, әйгілі Цельсийдің температуралық шкаласында айтылған екі температура (реперлік нүктелер) ретінде – мұздың еру температурасы  мен судың атмосфералық қысымда қайнау температурасы
мен судың атмосфералық қысымда қайнау температурасы  алынған. Осы температуралық интервал бірдей 100 бөлікке бөлінген. Сондықтан, бұл шкаланың градусы былай анықталады:
алынған. Осы температуралық интервал бірдей 100 бөлікке бөлінген. Сондықтан, бұл шкаланың градусы былай анықталады: 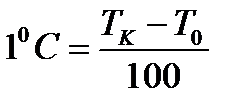 . Осындай тәсілді қолданып көптеген термометрлер мен температуралық шкала құруға болады.
. Осындай тәсілді қолданып көптеген термометрлер мен температуралық шкала құруға болады.
Ғылымның тарихында, мысалы, Реомюр температурылық шкаласы (Париж, 1750 ж.), Цельсий шкаласы (Швеция, 1742 ж.), Фаренгейт пікаласы (Англия, 1724 ж.) орын тапқан. Мысалы, Фаренгейт шкаласы қазіргі заманда АҚІІІ-та қолданады, 1°Ғ=5/9 °С.
Қазіргі термометрия идеал газдың шкаласы бойынша негізделген. Бұл термометрлік шкаласы газ термометрі көмегімен тағайындалады. Газ термометрі деген идеал газбен толтырылған, қысымын өлшейтін манометрмен жабдықталған жабық ыдыс. Бұл термометрдің термометрлік заты – идеал газ, ал термометрлік шамасы ретінде тұрақты көлем кезіндегі газдың қысымы алынады. Көлемі тұрақты болғанда газдың белгілі массасының қысымының температураға тәуелділігі сызықтық деп есептеледі. Газ термометрінде термометрлік зат ретінде төменгі температурада сутегі немесе гелийді, ал жоғарғы температурада азотты пайдаланады.
Бұл жорамал бойынша судың қайнау және мұздың еру температураларына сәйкес қысымдарының қатысы, осы температуралардың өздерінің катысына тең болады:
 , (31)
, (31)
мұндағы  – газ термометріндегі идеал газдың судың
– газ термометріндегі идеал газдың судың 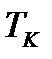 қайнау температурасындағы қысымы;
қайнау температурасындағы қысымы; 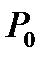 - газ термометріндегі идеал газдың мұздың еруінің
- газ термометріндегі идеал газдың мұздың еруінің  температурасындағы қысымы.
температурасындағы қысымы.
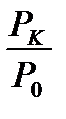 – қатынасы тәжірибеден анықталады. Көптеген өлшеу нәтижелерінен мынандай қатынас табылды:
– қатынасы тәжірибеден анықталады. Көптеген өлшеу нәтижелерінен мынандай қатынас табылды: 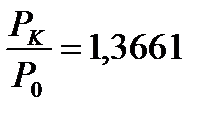 . Онда температуралар қатынасы да сондай шамаға тең болады:
. Онда температуралар қатынасы да сондай шамаға тең болады:  .
.
Градустың өлшемін 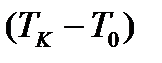 айырмасын жүз бөлікке бөліп табады:
айырмасын жүз бөлікке бөліп табады:
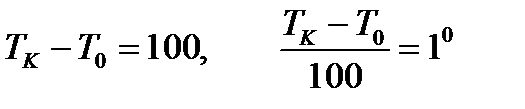 . (32)
. (32)
(31) және (32) өрнектерден мұздың атмосфералық қысымда еритін температурасы 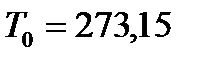 градус, ал судың қайнау температурасы 373,15 градус шығады.
градус, ал судың қайнау температурасы 373,15 градус шығады.
Газ термометрімен дененің температурасын өлшеу үшін, денені термометрмен түйістіреді немесе жалғастырады, содан соң жүйеде жылулық тепе-теңдік орналасқаннан кейін, термометрдегі газдың қысымын өлшейді. Сөйтіп, дененің температурасы төмендегі өрнектен табылады:
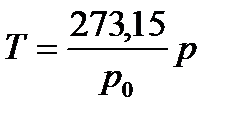 , (33)
, (33)
мұндағы 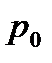 - еріп тұрған мұздағы термометрдегі газдың қысымы.
- еріп тұрған мұздағы термометрдегі газдың қысымы.
Практикада газ термометрі басқа барлық термометрлерді градуирлеу үшін қолданылады.
Идеал газдың температуралық шкаласы бойынша, температураның нольдік мәні газдың қысымы нольге тең болуына сәйкес келеді. Егер термометрлік шкаланың, ноль мәнінде термометрлік шама ноль болса, мұндай шкаланы абсолюттік шкала деп атайды. Осы абсолюттік шкала бойынша анықталған температура абсолюттік температура деп аталады және Т деп белгіленеді.
Сондықтан газтермометрінің шкаласы абсолюттік болады. Осы шкаланы Кельвин шкаласы деп те атайды. Кельвин шкаласындағы температураның өлшем бірлігін Кельвин градусы немесе кельвин дейді және К деп белгілейді.
Кең таралған Цельсий шкаласының градусы Кельвин шкаласының градусымен сәйкестендірілген.

деп жазуымызға болады. Мұндағы, 273,15 саны Цельсий шкаласындағы температураның нөлдік мәні, мұздың атмосфералық қысымда еритін температурасына сәйкес. Цельсий шкаласындағы температура белгісі 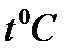 болады.
болады.
Барометрлік формула
Молекулалық-кинетикалық теорияның негізгі теңдеулерін жазған кезде молекулаларға сырттан ешқандай күш әсер етпейді. Сондықтан молекулалар ыдыс ішінде жылдамдықтары бойынша біртекті таралады деп жорығанбыз.
Бірақ кез-келген молекула жердің тартылу өрісінде орналасқандықтан оған ауырлық күші әсер етеді. Молекула әрдайым жылулық, хаосты қозғалыста болғандықтан, олар тартылу өрісінде белгілі биіктікке байланысты өзгеріп отырады.
Атмосфералық  қысымның
қысымның 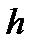 биіктікке тәуелділік өрнегін барометрлік формула деп атайды.
биіктікке тәуелділік өрнегін барометрлік формула деп атайды.
Барометрлік формуланы шығару үшін мынадай алғы шарттар жүзеге асырылады:
– тартылу өрісі біртекті;
– температура тұрақты;
– барлық молекулалардың массалары бірдей;
– еркін түсу үдеуі тұрақты.
Егер атмосфералық қысым 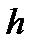 биіктікте
биіктікте  болса, онда
болса, онда  биіктікте ол
биіктікте ол 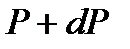 (
( 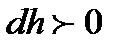 ,
,  биіктік өскен сайын қысым төмендейді).
биіктік өскен сайын қысым төмендейді).
| h2 |
| dh |
| h |
| h1 |
| P1 |
| P2 |
| P+dP |
| P |
3 - сурет
Сонда  мен
мен 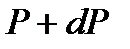 айырымы тік цилиндрдің бірлік табан ауданы мен
айырымы тік цилиндрдің бірлік табан ауданы мен  биіктігіне сәйкес көлеміндегі газ салмағына тең.
биіктігіне сәйкес көлеміндегі газ салмағына тең.
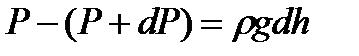
мұндағы  газдың
газдың  биіктіктегі тығыздығы.
биіктіктегі тығыздығы.
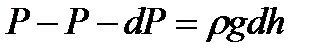
немесе
 (34)
(34)
Енді Менделеев-Клайперон теңдеуінен газ тығыздығы 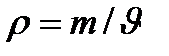
 немесе
немесе 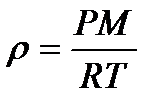 (35)
(35)
мұндағы 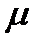 - молярлық масса, сонда (34), (35)-ші теңдеулерден
- молярлық масса, сонда (34), (35)-ші теңдеулерден
 (36)
(36)
Газ деңгейі  -ден
-ден  -ге көтерілген қысым
-ге көтерілген қысым 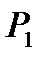 -ден
-ден 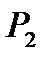 -ге өзгереді.
-ге өзгереді.
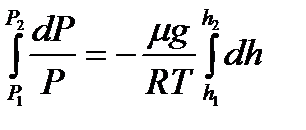
Бұдан
 (37)
(37)
Егер бастапқы биіктік 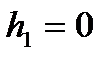 ,
, 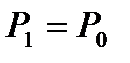 ,
, 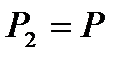 , ал
, ал 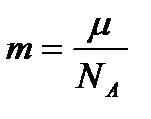 , деп алсақ, онда (37) теңдеуді былай жазамыз:
, деп алсақ, онда (37) теңдеуді былай жазамыз:
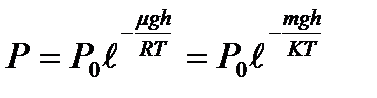
немесе молекулалық-кинетикалық теорияның негізгі теңдеуін 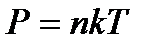 еске алсақ, онда
еске алсақ, онда
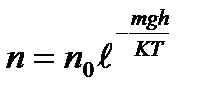 (38)
(38)
мұндағы 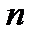 мен
мен 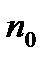 биіктіктердің аралығы
биіктіктердің аралығы 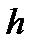 болатын нүктелердегі бірлік көлемге келетін молекулалар саны.
болатын нүктелердегі бірлік көлемге келетін молекулалар саны.
Негізгі әдебиеттер:
1. Әлжанов К.К., Құсаинов К.К., Мүсенов К.Қ., Дәрібеков С. Молекулалық физика. Қарағанды. ҚарМУ.2003
2. Құлбекұлы М. Молекулалық физика және термодинамика. Алматы, Қарасай баспасы. 2005
3. Қойшыбаев Н. Молекулалық физика. Алматы, Зият пресс баспасы. 2005
Қосымша әдебиеттер:
1. Қойшыбаев Н., Шарықбаев А.О. Физика. Алматы. 2001
2. Савельев И.В. Жалпы физика курсы. М., Наука, 1986.
3. Дәрібеков С. Материалдар физикасының негіздері. ҚарМУ 2005.
| <== предыдущая лекция | | | следующая лекция ==> |
| Вопрос 4. Работоспособность и ее динамика | | |
Дата добавления: 2015-09-28; просмотров: 17357;
