Наличие в стали легирующих элементов влияет на растворимость кислорода (С и Si сильно снижают растворимость О2).
Кислород может окислять легирующие элементы:
С + О → СО; (4.8)
Мn + O → MnO; (4.9)
Si + 2O → SiO2. (4.10)
Закись железа может взаимодействовать с легирующими элементами:
FeO + C ↔ CO + Fe; (4.11)
FeO + Mn ↔ Mn + Fe; (4.12)
2Fe O + Si ↔ SiO2 + 2Fe. (4.13)
Кислород в стали ухудшает все свойства: пределы прочности σв и текучести σт, относительное удлинение δ % и ударную вязкость α.
С ростом кислорода:
1) уменьшается стойкость против коррозии;
2) растет склонность к старению;
3) при О2 > 0,08 % возникает хладно и красноломкость;
4) усиливается рост зерен при нагреве;
5) ухудшается обрабатываемость резанием и ковка;
6) понижается магнитная проницаемость и увеличивается электрическое сопротивление.
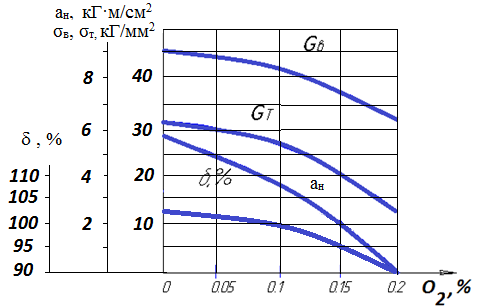
Рис. 4.3. Влияние содержания кислорода на механические свойства м/у стали
0.22.2. Влияние азота на свойства стали
Атомарный азот растворяется в тех металлах, с которыми он может образовывать химические соединения – нитриды. В сталях азот образует нитриды как с железом, так и с большинством примесей. С железом азот дает два нитрида:
4Fe + 1/2N2 ⇆ Fe4N – 11,25 кДж/моль; (4.14)
2 Fe + 1/2N2 ⇆ Fe2N – 16,25 кДж/моль. (4.15)
Нитриды железа образуются в области пониженных температур (700–550оС), при более высоких температурах они диссоциируют.
Азот образует с легирующими элементами нитриды, гораздо более стойкие, чем нитриды железа, особенно нитриды кремния и титана.
Пути насыщения металла азотом:
1) диссоциированный азот непосредственно растворяется в жидком металле, а при понижении температуры образуются нитриды железа;
2) диссоциированный азот образует при высоких температурах стойкие нитриды, которые растворяясь в жидком металле, насыщают его азотом;
3) диссоциированный азот образует при высоких температурах окись азота NO, которая растворяется в каплях. При температурах меньше 1000°С NО выпадает из твердого раствора и диссоциирует, образуя нитриды железа и оксиды.
С увеличением содержания азота:
1) появляется склонность металла к старению;
2) появляется склонность металла к хладно и синеломкости;
3) увеличивается способность к закалке;
4) понижается магнитная проницаемость;
5) увеличивается электросопротивление.
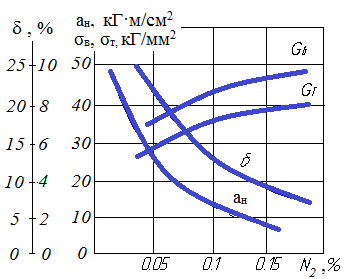
Рис. 4.4. Влияние содержания азота на механические свойства м/у стали
0.22.3. Влияние водорода на свойства стали
Водород может оказывать двоякое действие на металл.
1. Защищает от окисления и насыщения кислородом и азотом; восстанавливает металл из оксидов.
2. Растворяясь в металле, становится причиной пористости и трещин.
Атомарный водород Н растворяется как в твердом, так и особенно сильно в жидком железе. Наиболее значительное насыщение водородом происходит в процессе переноса капель.
Образование в газовой среде соединений ОН и НF, нерастворимых в жидком металле, снижает насыщенность металла водородом.
Находясь в окисленном жидком металле, водород взаимодействуют с кислородом:
2[H] + [H] → H2O ↑, (4.16)
где квадратные скобки означают растворенные в металле элементы;
[H] + [O] → OH ↑ (4.18)
[H]·[O] = const (4.17)
Поэтому наличие в металле кислорода ограничивает концентрацию водорода.
Не успевший выделиться при быстром охлаждении водород задерживается в ветвях дендритов и у поверхностей кристаллов. Здесь атомы воссоединяются в молекулы, парциальное давление атомарного водорода резко снижается, и он продолжает сюда диффундировать. Молекулярный водород создает большие давления, т.к. не растворим в металле, так же как и водяной пар, в который может окислиться водород. В металле возникает объемное напряженное состояние, приводящее к снижению пластических свойств и к хрупкому разрушению.
Особенно опасно наличие водорода в легированных сталях (С, Ni, Mn и др.), увеличивающих его растворимость. Вследствие разновременности полиморфных превращений γ-железа в шве и в основном металле в переходной зоне скапливается водород и возникают трещины.
0.22.4. Влияние окиси углерода на свойства стали
Окись углерода, будучи нерастворимой в жидком металле, прямой опасности не представляет. Наоборот, она способна создать защитную атмосферу у поверхности сварочной ванны.
При взаимодействии углерода с оксидами образующаяся окись углерода приводит к «кипению» металла;
FeO + C ↔ CO↑ + Fe, (4.19)
способствуещему удалению всех посторонних включений. Если в металле шва нет нужных раскислителей (Si, Mn и т.д.), способных подавить «кипение», то может снизиться содержание углерода и образоваться поры.
Карбидообразование железа и других металлов может происходить:
- непосредственно: Ме + С ↔ МеС;
- в атмосфере СО и СО2: Ме + 2СО ↔ МеС + СО2
- в атмосфере углеводородов: Сn Hm + Me ↔ MeC + Cn-1Hm
Карбиды образуют почти все металлы, но они обладают различными свойствами.
1. Карбиды с кубической кристаллической решеткой – наиболее тугоплавкие и устойчивые TiC, ZrC, VC, NbC, T0C, Cr23C6;
2. Карбиды с гексагональной решеткой MoC, W2C, WC, Ni3C, Cr7C2, …;
3. Карбиды с ромбической решеткой Cr3C2, Mo2C, Mn3C, Fe3C.
Дата добавления: 2015-09-28; просмотров: 1323;
