Диффузия ядер в металлах
Многие процессы, протекающие в металлах (кристаллизация, фазовые превращения и др.), особенно при высоких температурах связаны с диффузией.
Под диффузией понимают перемещение ядерных остовов в кристалле на расстояния, превышающие средние межатомные для данного вещества. Если трансформация атомов не связана с изменением концентрации диффундирующего вещества в отдельном объеме, то это самодиффузия.
Процесс диффузии ядер в металлах вызван тем, что в кристаллах они при любой температуре постоянно движутся – колеблются. Колебания сопровождаются обменом энергии между частицами. При этом отдельные ядерные остовы приобретают достаточно высокий запас энергии и амплитуду своих колебаний, что они смещаются со своих мест.
Различают несколько механизмов диффузии: обменный, циклический, межузельный и вакансионный (рис. 1.63).
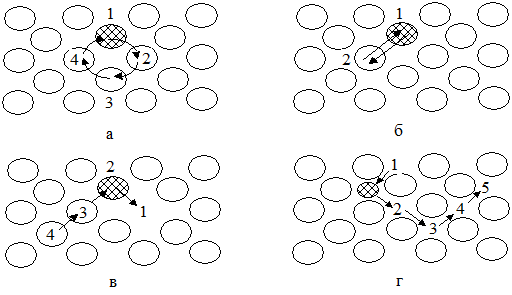
Рис. 1.63 – Модель механизмов диффузии: а - обменный, б - циклический, в – межузельный, г – вакансионный
Реализация того или иного механизма зависит от энергии активации Еа (Q). Поэтому термодинамически выгодным будет тот механизм, в котором энергия активации минимальна. Величина энергетического барьера зависит от сил межатомной связи и дефектов кристаллической решетки, которые облегчают диффузионные процессы (Еа по границам зерен вдвое меньше, чем в их объеме). Для металлов наиболее приемлемым является вакансионный механизм. Он заключается в том, что атом обменивается местами с вакансией. В этом случае атом, обладающий повышенной энергией и амплитудой колебаний, перемещается из узла или с поверхности кристалла на место вакансии, а образовавшиеся пустоты стремятся занять соседние атомы.
Процесс диффузии описывается двумя законами, получившими название первого и второго законов Фика.
Первый закон читается следующим образом: изменение количества диффундирующего вещества в единицу времени пропорционально градиенту концентрации, коэффициенту диффузии и единице поверхности и записывается формулой (1.8), где m – масса вещества, г; t – промежуток времени, мин; D – коэффициент диффузии; S – площадь поверхности диффузии; dc/dx – градиент концентрации, г/мм. Знак минус говорит о том, что процесс протекает в направлении обратном изменению концентрации, т. е. из зоны с большей в область с меньшей.
dm/dt = - D·dSdc/dx, (1.8)
Второй закон был выведен из первого при допуске, что коэффициент диффузии не зависит от концентрации, т. е. он справедлив для самодиффузии и записывается согласно выражению (1.9).
dc/dt = D·d2c/dx2 (1.9).
Коэффициент диффузии D (см2/с) имеет следующий физический смысл. Это количество диффундирующего вещества через единицу площади (1, см2) в единицу времени (1, с) при изменении концентрации, равной 1. Он зависит от природы металла, размеров его зерен в кристаллической решетке и наиболее сильно от температуры.
С. Аррениус вывел экспоненциальную зависимость коэффициента диффузии от температуры, описываемую формулой (1.10), где Q – энергия активации диффузии, R – газовая постоянная, Т – температура и D0 – предэкспоненциальный множитель, величина которого определяется типом кристаллической решетки металла.
D = D0e-Q/RT, (1.10)
Для совершения элементарного акта диффузии атом должен осилить энергетический барьер. Средняя тепловая энергия атома значительно меньше энергии активации, необходимой для преодоления барьера при переходе атомов из одного состояния в другое. Требуемый для этого избыток энергии приобретается частицей от ее соседей при их столкновениях, в которых осуществляется обмен кинетической энергией. Энергия активации очень сильно влияет на коэффициент диффузии, так как она является показателем степени в уравнении.
Наиболее легко диффузия протекает по поверхности и границам зерен, где сосредоточены дефекты кристаллической решетки металлов.
Дата добавления: 2015-09-21; просмотров: 1637;
